题目内容
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为:3Zn + 2K2FeO4 + 8H2O 3Zn(OH)2 + 2Fe(OH)3 + 4KOH,下列叙述不正确的是
3Zn(OH)2 + 2Fe(OH)3 + 4KOH,下列叙述不正确的是
 3Zn(OH)2 + 2Fe(OH)3 + 4KOH,下列叙述不正确的是
3Zn(OH)2 + 2Fe(OH)3 + 4KOH,下列叙述不正确的是| A.放电时K+ 向负极移动 |
| B.放电时负极区域的pH会增大 |
| C.充电时锌极与外电源负极相连 |
| D.充电时阳极反应为:Fe(OH)3-3e- + 5OH-="===" FeO42- + 4H2O |
AB
试题分析:高铁电池放电时必定是锌在负极失去电子,高铁酸钾在正极得到电子。所以K+ 向正极移动,放电时正极附近生成OH-离子,碱性要增强。充电时,锌极与外电源正极相连,阳极上氢氧化铁转化成高铁酸钾,阳极反应为:Fe(OH)3-3e- + 5OH-="===" FeO42- + 4H2O
点评:本题难度大,考查运用原电池、电解等基础理论解决新情景问题的能力。这类题目关键是要分析清楚电子的流向,确定电极反应式,本试题又跟能源问题相联系使试题很有吸引力。

练习册系列答案
 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
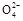 只向PbO2处移动
只向PbO2处移动
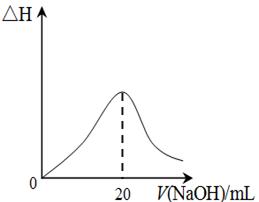
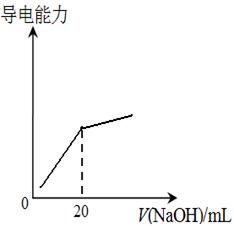
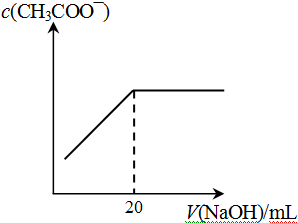
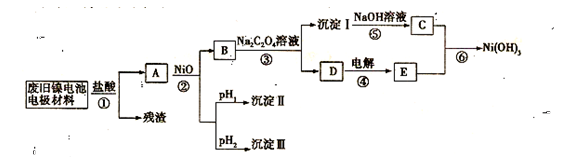
 M+Ni(OH)2,M为储氢合金,MH为吸附了氢原子的储氢合金。电解质溶液为浓KOH溶液。
M+Ni(OH)2,M为储氢合金,MH为吸附了氢原子的储氢合金。电解质溶液为浓KOH溶液。