题目内容
把Mg和MgO的混合物共7 g,加入稀H2SO4 150 mL,标准状况下放出H2 1.68 L,Mg、MgO完全溶解,为中和过量H2SO4,并使Mg2+完全转化为Mg(OH)2沉淀,用去3 mol·L-1的NaOH溶液200 mL,则该H2SO4溶液的物质的量浓度为( )
| A.115 mol·L-1 | B.1 mol·L-1 | C.3 mol·L-1 | D.2 mol·L-1 |
D
不用计算Mg、MgO的量分别为多少,根据终态结果,溶液中溶质成分为Na2SO4,Na+来自于NaOH,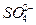 来自于H2SO4,故n(NaOH)=2n(H2SO4)。
来自于H2SO4,故n(NaOH)=2n(H2SO4)。
n(H2SO4)=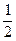 ×3 mol·L-1×0.2 L="0.3" mol
×3 mol·L-1×0.2 L="0.3" mol
c(H2SO4)=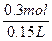 ="2" mol·L-1
="2" mol·L-1
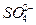 来自于H2SO4,故n(NaOH)=2n(H2SO4)。
来自于H2SO4,故n(NaOH)=2n(H2SO4)。n(H2SO4)=
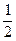 ×3 mol·L-1×0.2 L="0.3" mol
×3 mol·L-1×0.2 L="0.3" molc(H2SO4)=
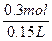 ="2" mol·L-1
="2" mol·L-1
练习册系列答案
相关题目
 mol·L-1
mol·L-1 g·cm-3
g·cm-3 %
% V mol·L-1
V mol·L-1 mol·L-1
mol·L-1 mol·L-1
mol·L-1 mol·L-1
mol·L-1