题目内容
将50g溶质质量分数为w1,物质的量浓度为c1的浓硫酸沿玻璃棒加入到Vml水中,稀释后得到溶质质量分数为w2,物质的量浓度为c2的稀溶液。下列说法中正确的是
| A.若c1 = 2c2,则w1<2w2,V<50 mL | B.若c1 = 2c2,则w1<2w2,V>50 mL |
| C.若w1 = 2w2,则c1<2c2,V="50" mL | D.若w1 = 2w2,则c1>2c2,V<50 mL |
A
本题主要考查浓度的计算与换算,此考点也是化学常用计量中的热门考点。设溶液的体积为V L,密度为ρ g·mL-1,溶质的摩尔质量为M g·mol-1,质量分数为w,物质的量浓度为c mol·L-1,则根据溶液浓度表达方式不同,但其溶质不变有: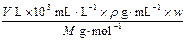 =V L·c mol·L-1,即c=
=V L·c mol·L-1,即c=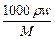 。若w1 = 2w2,
。若w1 = 2w2,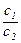 =
=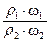 =2·
=2·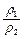 ,由于?ρ2<?ρ1,所以c1>2c2。稀释后质量分数减半,说明浓硫酸与水等质量混合,水的密度可认为是1g/cm3,因此V值等于50mL。若c1 = 2c2,
,由于?ρ2<?ρ1,所以c1>2c2。稀释后质量分数减半,说明浓硫酸与水等质量混合,水的密度可认为是1g/cm3,因此V值等于50mL。若c1 = 2c2, =
=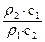 =2
=2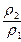 ,由于?ρ2<ρ?1,所以w1<2w2,同时可知V<50 mL。本题应选A。
,由于?ρ2<ρ?1,所以w1<2w2,同时可知V<50 mL。本题应选A。
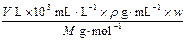 =V L·c mol·L-1,即c=
=V L·c mol·L-1,即c=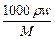 。若w1 = 2w2,
。若w1 = 2w2,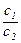 =
=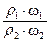 =2·
=2·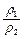 ,由于?ρ2<?ρ1,所以c1>2c2。稀释后质量分数减半,说明浓硫酸与水等质量混合,水的密度可认为是1g/cm3,因此V值等于50mL。若c1 = 2c2,
,由于?ρ2<?ρ1,所以c1>2c2。稀释后质量分数减半,说明浓硫酸与水等质量混合,水的密度可认为是1g/cm3,因此V值等于50mL。若c1 = 2c2, =
=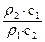 =2
=2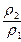 ,由于?ρ2<ρ?1,所以w1<2w2,同时可知V<50 mL。本题应选A。
,由于?ρ2<ρ?1,所以w1<2w2,同时可知V<50 mL。本题应选A。
练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目





