题目内容
19.下列配制的溶液浓度偏高的是( )| A. | 配制稀盐酸用量筒量取浓盐酸时,俯视刻度线 | |
| B. | 用量筒量取所需的浓盐酸倒入烧杯后,再用水洗量筒 2~3 次,洗液倒入烧杯中 | |
| C. | 称量 11.7 g NaCl 配制 0.2 mol/L NaCl 溶液时,砝码错放在左盘 | |
| D. | 定容时仰视刻度线 |
分析 分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析,凡是n增大或者使V减小的操作,配制的溶液浓度偏高,反之,溶液浓度偏低.
解答 解:A.配制稀盐酸用量筒量取浓盐酸时,俯视刻度线,导致量取的浓盐酸体积偏小,即溶质氯化氢的物质的量偏小,依据C=$\frac{n}{V}$,溶液浓度偏低,故A错误;
B.用量筒量取所需的浓盐酸倒入烧杯后,再用水洗量筒 2~3 次,洗液倒入烧杯中,导致量取的盐酸体积偏大,即溶质氯化氢的物质的量偏大,依据C=$\frac{n}{V}$,溶液浓度偏高,故B正确;
C.依据托盘天平中左盘质量=右盘质量+游码质量,砝码错放在左盘,则实际称量的质量为11g-0.7g=10.3g,实际称取的溶质的质量偏小,溶质的物质的量偏小,依据C=$\frac{n}{V}$,溶液浓度偏低,故C错误;
D.定容时仰视刻度线,导致溶液体积偏大,依据C=$\frac{n}{V}$,溶液浓度偏低,故D错误;
故选:B.
点评 本题考查配制一定物质的量浓度的溶液的误差分析,题目难度中等,注意根据c=$\frac{n}{V}$分析不当操作对n或V的影响进行分析.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
10.关于物质分类的正确组合是( )
| 分类 组合 | 碱 | 酸 | 盐 | 碱性氧 化物 | 酸性氧 化物 |
| A | 纯碱 | 盐酸 | 烧碱 | 氧化铝 | 二氧化碳 |
| B | 烧碱 | 硫酸 | 食盐 | 氧化镁 | 一氧化碳 |
| C | 苛性钠 | 醋酸 | 碳酸铵 | 过氧化钠 | 二氧化硫 |
| D | 苛性钾 | 盐酸 | 小苏打 | 氧化钠 | 三氧化硫 |
| A. | A | B. | B | C. | C | D. | D |
4.有甲、乙两种有机物其结构如图所示,下列说法正确的是( )


| A. | 两者既不互为同系物,又不是同分异构体 | |
| B. | 甲比乙的沸点高,密度大 | |
| C. | 在光照下与氯气反应生成的一氯代物分别是三种和两种 | |
| D. | 同质量的甲与乙完全燃烧,甲消耗氧气多 |
11.酶是一种( )
| A. | 糖类 | B. | 蛋白质 | C. | 油脂 | D. | 维生素 |
8.下列说法正确的是( )
| A. | OTC表示处方药,R表示非处方药 | |
| B. | 尽量避免使用快餐盒打包滚烫的食物 | |
| C. | 浓硫酸溅在皮肤上,使皮肤呈黄色 | |
| D. | 具有热固性的高分子材料受热会熔化 |
9.标准状况下有①6.72L CH4 ②3.01×1023个HCl ③13.6g H2S ④0.2mol NH3,下列对四种气体的关系从小到大表示不正确的是( )
| A. | 密度 ①<④<③<② | B. | 氢原子数 ④<②<③<① | ||
| C. | 质量 ④<①<③<② | D. | 体积④<①<③<② |
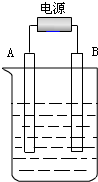 在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色稀溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量,电极增重1.6g.请回答下列问题:
在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色稀溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量,电极增重1.6g.请回答下列问题: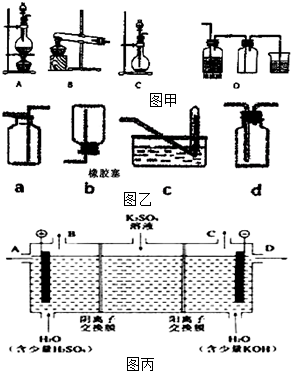 实验室常用的几种气体发生装置如图甲A、B、C所示:
实验室常用的几种气体发生装置如图甲A、B、C所示:
 .
.