题目内容
9.标准状况下有①6.72L CH4 ②3.01×1023个HCl ③13.6g H2S ④0.2mol NH3,下列对四种气体的关系从小到大表示不正确的是( )| A. | 密度 ①<④<③<② | B. | 氢原子数 ④<②<③<① | ||
| C. | 质量 ④<①<③<② | D. | 体积④<①<③<② |
分析 根据n=$\frac{V}{{V}_{m}}$计算6.72LCH4的物质的量,根据n=$\frac{N}{{N}_{A}}$计算HCl的物质的量,根据n=$\frac{m}{M}$计算13.6gH2S的物质的量.
A.相同条件下,密度之比等于摩尔质量之比;
B.根据各分子含有的H原子数目,计算各物质含有的H原子物质的量,H原子物质的量越大,含有原子数目越大;
C.根据m=nM计算甲烷、HCl、氨气的质量进行判断;
D.相同条件下,气体体积之比等于其物质的量之比.
解答 解:①6.72LCH4的物质的量为$\frac{6.72L}{22.4L/mol}$=0.3mol,②3.01×1023个HCl的物质的量为$\frac{3.01×1{0}^{23}}{6.02×1{0}^{23}mo{l}^{-1}}$=0.5mol,③13.6gH2S的物质的量为$\frac{13.6g}{34g/mol}$=0.4mol,④0.2molNH3.
A.相同条件下,密度之比等于摩尔质量之比,故密度①<④<③<②,故A正确;
B.甲烷中n(H)=0.3mol×4=1.2mol,HCl中n(H)=0.5mol,硫化氢中n(H)=0.4mol×2=0.8mol,氨气中n(H)=0.2mol×3=0.6mol,故H原子数目②<④<③<①,故B错误;
C.根据m=nM知,甲烷质量为0.3mol×16g/mol=4.8g,HCl的质量为0.5mol×36.5g/mol=33.25g,氨气的质量为0.2mol×17g/mol=3.4g,故质量④<①<③<②,故C正确;
D.根据V=nVm知,相同条件下,气体体积之比等于其物质的量之比,故体积④<①<③<②,故D正确;
故选B.
点评 本题考查了阿伏伽德罗定律及其推论,明确物质的量的基本公式中各个物理量之间的关系是解本题关键,题目难度不大.

| A. | 配制稀盐酸用量筒量取浓盐酸时,俯视刻度线 | |
| B. | 用量筒量取所需的浓盐酸倒入烧杯后,再用水洗量筒 2~3 次,洗液倒入烧杯中 | |
| C. | 称量 11.7 g NaCl 配制 0.2 mol/L NaCl 溶液时,砝码错放在左盘 | |
| D. | 定容时仰视刻度线 |
| A. | n | B. | $\frac{n}{m}$ | C. | $\frac{12n}{m}$ | D. | n×NA |
| A. | I-、CO32-、SO42- | B. | SO42-、CO32-、I- | C. | CO32-、SO42-、I- | D. | CO32-、I-、SO42- |
(1)已知:2N2H4(l)+N2O4(l)═3N2(g)+4H2O(l)△H=-1225kJ.mol-1
| 化学键 | N-H | N-N | N≡N | O-H |
| 键能(kJ.mol-1) | 390 | 190 | 946 | 460 |
(2)800℃时,某密闭容器中存在如下反应:2NO2(g)?2NO(g)+O2(g)△H>0,若开始向容器中加入1mol/L的NO2,反应过程中NO的产率随时间的变化如图曲线I所示.
①反应Ⅱ相对于反应I而言,改变的条件可能是加入催化剂.
②请在图中绘制出在其它条件与反应I相同时,反应在820℃时进行,NO的产率随时间的变化曲线.
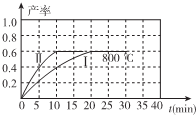
③800℃时,若开始时向容器中同时加入1mol/LNO、0.2mol/LO2、0.55mol/L N02,则v(正)>v(逆)
(3)己知N2H4(g)?2NO2(g)△H=+57.20kJ/mol,t时,将一定量的NO2、N2O4,充人一个容器为2L的恒容密闭容器中,浓度随时间变化关系如下表所示:
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| c(X)/(mol/L) | 0.2 | c | 0.6 | 0.6 | 1.0 | c1 | c1 |
| c(Y)(mol/L) | 0.6 | c | 0.4 | 0.4 | 0.4 | c2 | c2 |
②前10min内用NO2表示的反应速率为0.04mol/(L.min),20min时改变的条件是增大NO2的浓度;重新达到平衡时,NO2的百分含量b(填选项前字母).
a.增大 b.减小 c.不变 d.无法判断.
| A. | 12 | B. | 10 | C. | 6 | D. | 4 |
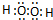 .
.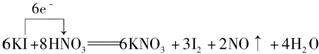 .
.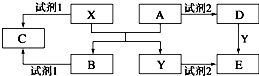 A、B、C、D、E是中学化学常见的5种化合物,其中A、B是氧化物.单质X、Y是生活中常见的金属,相关物质间的转化关系如图所示(部分反应物与产物已略去):
A、B、C、D、E是中学化学常见的5种化合物,其中A、B是氧化物.单质X、Y是生活中常见的金属,相关物质间的转化关系如图所示(部分反应物与产物已略去):