题目内容
10.关于物质分类的正确组合是( )| 分类 组合 | 碱 | 酸 | 盐 | 碱性氧 化物 | 酸性氧 化物 |
| A | 纯碱 | 盐酸 | 烧碱 | 氧化铝 | 二氧化碳 |
| B | 烧碱 | 硫酸 | 食盐 | 氧化镁 | 一氧化碳 |
| C | 苛性钠 | 醋酸 | 碳酸铵 | 过氧化钠 | 二氧化硫 |
| D | 苛性钾 | 盐酸 | 小苏打 | 氧化钠 | 三氧化硫 |
| A. | A | B. | B | C. | C | D. | D |
分析 碱指电离时产生的阴离子全部都是氢氧根离子的化合物;
酸指电离时产生的阳离子全部都是氢离子的化合物;
盐指电离时生成金属阳离子(或NH4+)和酸根离子的化合物;
碱性氧化物指与水反应生成碱的氧化物或能跟酸起反应生成一种盐和水的氧化物(且生成物只能有盐和水,不可以有任何其它物质生成);
酸性氧化物是指能与水作用生成酸或与碱作用生成盐和水的氧化物(且生成物只能有一种盐和水,不可以有任何其它物质生成).
解答 解:A、纯碱是碳酸钠,属于盐不是碱,故A错误;
B、CO为不成盐氧化物,不是酸性氧化物,故B错误;
C、Na2O2与酸反应除了生成盐和水,还生成氧气,不属于碱性氧化物,故C错误;
D、KOH属于碱,HCl属于酸,小苏打碳酸钠属于盐,氧化钠与酸化合生成钠盐和水,为碱性氧化物,SO3与水化合为硫酸,属于酸性氧化物,故D正确.
故选:D.
点评 本题是对物质的化学式及分类的考查,对物质的名称、分类及化学式有较明确的认识即可顺利解答,属基础知识考查题,难度不大.

练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目
1.你认为下列说法不合理的是( )
| A. | 塑料制品长期不使用也会老化 | |
| B. | 可以通过与盐酸的互滴实验鉴别碳酸钠和碳酸氢钠 | |
| C. | 过氧化钠可以作供氧剂,可以和二氧化硫反应生成亚硫酸钠和氧气 | |
| D. | 纯碱是 Na2C03,小苏打是 NaHC03,其水溶液均呈碱性 |
18.下列反应中,水做氧化剂的是( )
| A. | SO3+H2O═H2SO4 | B. | 2Na+2H2O═2NaOH+H2↑ | ||
| C. | 2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O | D. | 2F2+2H2O═4HF+O2 |
5.已知C2H4(g)和C2H5OH(l)的燃烧热分别是1411.0kJ/mol和1366.8 kJ/mol,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为( )
| A. | -44.2kJ/mol | B. | +44.2kJ/mol | C. | -330kJ/mol | D. | +330kJ/mol |
2.图象能直观地反映有关物理量的变化及规律,下列各图象与描述相符的是( )
 A.如图表示SO2氧化反应分别在有、无催化剂的情况下反应过程中的能量变化 A.如图表示SO2氧化反应分别在有、无催化剂的情况下反应过程中的能量变化 | 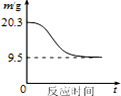 B.如图表示 0.1mol MgCl2•6H2O在空气中充分加热时固体质量随时间的变化 B.如图表示 0.1mol MgCl2•6H2O在空气中充分加热时固体质量随时间的变化 | 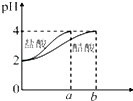 C.如图表示分别稀释10mL pH=2的盐酸和醋酸时溶液pH的变化,图中b>100 C.如图表示分别稀释10mL pH=2的盐酸和醋酸时溶液pH的变化,图中b>100 | 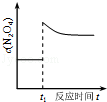 D.如图表示平衡2NO2(g)?N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化 D.如图表示平衡2NO2(g)?N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化 |
| A. | A | B. | B | C. | C | D. | D |
19.下列配制的溶液浓度偏高的是( )
| A. | 配制稀盐酸用量筒量取浓盐酸时,俯视刻度线 | |
| B. | 用量筒量取所需的浓盐酸倒入烧杯后,再用水洗量筒 2~3 次,洗液倒入烧杯中 | |
| C. | 称量 11.7 g NaCl 配制 0.2 mol/L NaCl 溶液时,砝码错放在左盘 | |
| D. | 定容时仰视刻度线 |
