题目内容
4.根据电子排布的特点,Br在周期表属于( )| A. | s区 | B. | p区 | C. | d 区 | D. | ds区 |
分析 周期表分为s区、p区、d区、ds区、f区,根据Br的外围电子排布式分析.
解答 解:周期表分为s区、p区、d区、ds区、f区,Ar的外围电子排布式为4s24p5,Br属于第VIIA族元素,在周期表中位于p区.
故选B.
点评 本题考查了周期表的分区,根据元素在周期表中的位置判断,题目比较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.根据下列操作及现象,所得结论不正确的是( )
| 序号 | 操作及现象 | 结论 |
| A | 将pH=11的氨水稀释10倍,测得pH由11变成 10.6 | NH3•H2O?NH4++OH-的电离程度增大 |
| B | “NO2球”浸泡在热水中,颜色加深 | 2NO2(g)?N2O4(g)△H<0 |
| C | 向25mL冷水和沸水中分别滴入5滴FeCl3饱和溶液,前者为黄色,后者为红褐色 | 温度升高,Fe3+的水解程度增大 |
| D | 将固体CaSO4加入Na2CO3饱和溶液中,一段时间后,检验固体成分为CaCO3 | 同温下溶解度: CaSO4<CaCO3 |
| A. | A | B. | B | C. | C | D. | D |
12.下列转化必须加入还原剂才能实现的是( )
| A. | KClO3→KCl | B. | H2O2→H2O | C. | CaCl2→CaCO3 | D. | FeCl3→FeCl2 |
19.两种硫酸溶液,一种硫酸溶液的物质的量浓度为C1,密度为ρ1;另一种硫酸溶液的物质的量浓度为C2,密度为ρ2,将它们等体积混合后,所得溶液的密度为ρ3,则混合后硫酸的物质的量浓度为( )
| A. | $\frac{({C}_{1}+{C}_{2}){ρ}_{3}}{{ρ}_{1}+{ρ}_{2}}$ | B. | $\frac{{C}_{1}+{C}_{2}}{{ρ}_{1}+{ρ}_{2}}$ | ||
| C. | $\frac{({C}_{1}+{C}_{2}){ρ}_{3}}{1000({ρ}_{1}+{ρ}_{2})}$ | D. | $\frac{1000({C}_{1}+{C}_{2}){ρ}_{3}}{{ρ}_{1}+{ρ}_{2}}$ |
9.下列有关NaHCO3和Na2CO3性质的比较中,正确的是( )
| A. | 热稳定性:Na2CO3<NaHCO3 | |
| B. | 常温时在水中的溶解度:Na2CO3>NaHCO3 | |
| C. | Na2CO3与Ca(OH)2反应有沉淀生成,NaHCO3与Ca(OH)2反应没有沉淀生成 | |
| D. | 等物质的量的NaHCO3和Na2CO3与足量稀盐酸反应,NaHCO3放出的CO2多 |
16.向20mL 1mol•L-1 NaAlO2的溶液中逐渐加入浓度为4mol•L-1的盐酸溶液,若产生0.78g白色沉淀,则加入的盐酸溶液的体积可能为( )
| A. | 3 mL | B. | 2.5 mL | C. | 12.5 mL | D. | 17.5 mL |
13.下列说法正确的是( )
| A. | 可用25mL碱式滴定管量取20.00mLKMnO4溶液 | |
| B. | 读取滴定管内液体的体积抑视会导致读数偏大 | |
| C. | 做中和滴定实验时,用待测液润洗锥形瓶 | |
| D. | 用盐酸标准溶液滴定待测的氢氧化钠溶液时,水洗后的酸式滴定管未经标准液润洗,则测定结果偏低 |
8.硝酸具有强氧化性,甲乙两组同学对硝酸的性质进行研究.
(1)甲组同学进行了铜与浓硝酸、稀硝酸反应的实验:
请回答:
①铜与稀硝酸反应的离子方程式是3Cu+8H++2NO3-(稀)═3Cu2++2NO?+4H2O.
②实验I能否说明溶液呈现不同颜色与硝酸铜的物质的量浓度无关?能(填“能”或“不能”),原因是两份溶液中硝酸铜的物质的量浓度相等.
③根据实验结果推测,铜与浓硝酸反应后溶液呈绿色的原因可能是反应生成的红棕色气体溶于生成的蓝色硝酸铜溶液.
④请另设计一个方案,验证你所得到的上述结论:方案一:取Cu与浓HNO3反应后的绿色溶液,向其中通入足量的空气(或氧气),溶液颜色由绿色逐渐变为蓝绿色,最终变为蓝色.
(2)乙组同学用足量浓硝酸和硫单质反应进行了实验探究.
假设硝酸的还原产物只有一种,乙组同学根据氧化还原反应推测硫的氧化产物,提出三种可能:I.只有硫酸;Ⅱ.只有二氧化硫;Ⅲ.二氧化硫和硫酸
乙组同学设计了下列实验,实验流程及步骤:
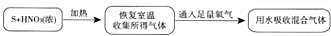
a.混合气体用水吸收后,测得无含硫、含氮物质逸出,并将吸收后的液体配成100.00mL溶液;
b.取a中所得溶液20.00mL,加入足量氯化钡溶液,得到0.466g白色沉淀;
c.再取20.00mLa中所得溶液,用氢氧化钠溶液中和,恰好用去0.6mol/L氢氧化钠溶液30.00mL.
请回答:
①二氧化氮和氧气的混合气体被水完全吸收的化学方程式为4NO2+O2+2H2O═4HNO3.
②步骤a中配制的100.00mL溶液中H+的物质的量浓度是0.9mol/L.
③该实验中收集到气体中含有NO2和SO2,假设III(填“I”“II”或“III”)成立.
④该实验中浓硝酸和硫反应的化学方程式为14HNO3(浓)+3S$\frac{\underline{\;△\;}}{\;}$2SO2↑+H2SO4+14NO2↑+6H2O.
(1)甲组同学进行了铜与浓硝酸、稀硝酸反应的实验:
| 实验组 | 实验操作 | 实验现象 |
| 实验1 | 在 I、II两支试管中分别加入等体积的浓硝酸和稀硝酸,再向两支试管中分别放入等质量的铜片. | 铜均无剩余,试管 I中溶液呈绿色;试管 II中溶液呈蓝色. |
| 实验2 | 分别取实验 I中的绿色溶液于 III、IV两试管中,对试管 III进行加热,向试管 IV中缓慢加入水,并不停振荡. |
①铜与稀硝酸反应的离子方程式是3Cu+8H++2NO3-(稀)═3Cu2++2NO?+4H2O.
②实验I能否说明溶液呈现不同颜色与硝酸铜的物质的量浓度无关?能(填“能”或“不能”),原因是两份溶液中硝酸铜的物质的量浓度相等.
③根据实验结果推测,铜与浓硝酸反应后溶液呈绿色的原因可能是反应生成的红棕色气体溶于生成的蓝色硝酸铜溶液.
④请另设计一个方案,验证你所得到的上述结论:方案一:取Cu与浓HNO3反应后的绿色溶液,向其中通入足量的空气(或氧气),溶液颜色由绿色逐渐变为蓝绿色,最终变为蓝色.
(2)乙组同学用足量浓硝酸和硫单质反应进行了实验探究.
假设硝酸的还原产物只有一种,乙组同学根据氧化还原反应推测硫的氧化产物,提出三种可能:I.只有硫酸;Ⅱ.只有二氧化硫;Ⅲ.二氧化硫和硫酸
乙组同学设计了下列实验,实验流程及步骤:

a.混合气体用水吸收后,测得无含硫、含氮物质逸出,并将吸收后的液体配成100.00mL溶液;
b.取a中所得溶液20.00mL,加入足量氯化钡溶液,得到0.466g白色沉淀;
c.再取20.00mLa中所得溶液,用氢氧化钠溶液中和,恰好用去0.6mol/L氢氧化钠溶液30.00mL.
请回答:
①二氧化氮和氧气的混合气体被水完全吸收的化学方程式为4NO2+O2+2H2O═4HNO3.
②步骤a中配制的100.00mL溶液中H+的物质的量浓度是0.9mol/L.
③该实验中收集到气体中含有NO2和SO2,假设III(填“I”“II”或“III”)成立.
④该实验中浓硝酸和硫反应的化学方程式为14HNO3(浓)+3S$\frac{\underline{\;△\;}}{\;}$2SO2↑+H2SO4+14NO2↑+6H2O.