题目内容
14.已知A、B、C、D、E为中学化学中常见的化合物,其中A是淡黄色固体,B是无色液体,甲、乙、丙为非金属单质,丁为地壳中含量最多的金属元素所组成的单质,C的焰色反应呈黄色,丙是黄绿色气体,它们之间的转化关系如图所示(有的反应部分产物已经略去):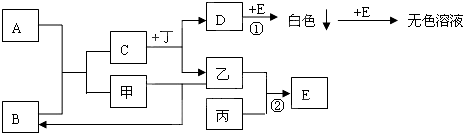
(1)在化合物D的水溶液中通入过量的CO2气体,写出发生反应的离子方程式AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
(2)已知Al(OH)3是难溶于水的两性氢氧化物.常温下,Ksp[Al(OH)3]=3.0×10-34.则该温度下,将0.1mol/L的AlCl3溶液调整到pH=4,此时溶液中c(Al3+)=3.0×10-4mol/L.
分析 A是淡黄色固体,B是无色液体,二者反应生成C与单质甲,且C的焰色反应呈黄色,可知A是Na2O2,B是H2O,甲、乙、丙为非金属单质,甲是O2,C是NaOH.丁为地壳中含量最多的金属元素所组成的单质,则丁是Al,与NaOH反应生成单质乙,则乙是H2,D是NaAlO2.丙是黄绿色气体单质,则丙是Cl2,由转化关系可知E是HCl,白色沉淀为氢氧化铝,以此解答该题.
解答 解:A是淡黄色固体,B是无色液体,二者反应生成C与单质甲,且C的焰色反应呈黄色,可知A是Na2O2,B是H2O,甲、乙、丙为非金属单质,甲是O2,C是NaOH.丁为地壳中含量最多的金属元素所组成的单质,则丁是Al,与NaOH反应生成单质乙,则乙是H2,D是NaAlO2.丙是黄绿色气体单质,则丙是Cl2,由转化关系可知E是HCl,白色沉淀为氢氧化铝,
(1)D为NaAlO2,与过量二氧化碳反应生成氢氧化铝和碳酸氢钠,反应的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(2)常温下,将0.1mol/L的AlCl3溶液调整到pH=4,c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-4}}$=10-10mol/L,Ksp[Al(OH)3]=c(Al3+)×c3(OH-)=3.0×10-34.此时溶液中c(Al3+)=$\frac{3.0×1{0}^{-34}}{(1{0}^{-10})^{3}}$=3.0×10-4mol/L,故答案为:3.0×10-4.
点评 本题考查无机物的推断,涉及Na、Al、Cl盐酸单质化合物性质以及电解、气体制备等,题目难度中等,注意根据物质的颜色、反应的现象为突破口进行推断,学习中注意元素化合物的性质,注重相关知识的积累.

| A. | 7.2 | B. | 8 | C. | 6 | D. | 7 |
| A. | 淀粉溶胶中混有的氯化钠可以利用渗析的方法除去 | |
| B. | 向氢氧化铁胶体中逐滴滴入硫酸溶液,可以观察到先出现红褐色沉淀而后沉淀溶解形成澄清溶液 | |
| C. | 胶体介稳的主要原因是胶体带有电荷 | |
| D. | 可以利用丁达尔效应来鉴别胶体和溶液 |
| A. | 增加砝码 | B. | 增加药品量 | C. | 减少药品量 | D. | 减少砝码 |
| A. | 因为NaCl溶液导电,所以NaCl晶体中含有离子键 | |
| B. | 因为N的最外层电子数为5,所以N2中有3个非极性共价键 | |
| C. | 因为NH4Cl全部由非金属元素组成,所以NH4Cl是共价化合物 | |
| D. | 因为Na2O2中的原子个数比是1:1,所以离子个数比也是1:1 |
| A. | CH3COOH | B. | 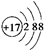 | C. | Fe3+ | D. | NH3•H2O |
| A. | s区 | B. | p区 | C. | d 区 | D. | ds区 |