题目内容
【题目】生产生活中广泛涉及氧化还原反应
Ⅰ.研究电化学腐蚀及防护的装置如图所示
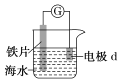
(1)若d为石墨,石墨上的电极反应式为_________________ ;
(2)若d为锌,锌上的电极反应式为___________________;
(3)将图中电流表换成外接电源,铁片接___________(填“正”或“负”)极被保护
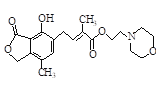
Ⅱ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钾的主要反应为:2FeSO4+ 6Na2O2![]() 2Na2FeO4+2Na2O+2Na2SO4+O2↑
2Na2FeO4+2Na2O+2Na2SO4+O2↑
①该反应中的氧化剂是________________,还原剂是_______________,每生成1 molNa2FeO4转移_______mol电子。
②简要说明K2FeO4作为水处理剂时所起的作用_________________________________
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①写出并配平湿法制高铁酸钾反应的离子方程式:____________________________。
②每生成1 mol FeO42-转移________mol电子,若反应过程中转移了0.3 mol电子,则还原产物的物质的量为________mol。
③低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),说明什么问题______。
【答案】O2+4e﹣+2H2O=4OH-Zn- 2e﹣= Zn2+负Na2O2Na2O2和FeSO45高铁酸钾具有强氧化性,能杀菌消毒;消毒过程中自身被还原为Fe3+,Fe3+水解生成Fe(OH)3胶体能吸附水中悬浮杂质而沉降2Fe(OH)3+ 3ClO-+ 4OH-=2FeO42—+3Cl-+ 5H2O30.15 mol该温度下K2FeO4比Na2FeO4的溶解度小
【解析】
Ⅰ(1)活泼金属铁片作负极,发生腐蚀,d为石墨,做正极,因为海水为中性,溶解在海水溶液中的氧气得电子,极反应为:O2+4e﹣+2H2O=4OH-;正确答案:O2+4e﹣+2H2O=4OH-。
(2)若d为锌,锌比铁活泼,锌做负极,发生氧化反应,极反应为:Zn- 2e﹣= Zn2+;正确答案:Zn- 2e﹣= Zn2+。
(3)将图中电流表换成外接电源,铁片接电源的负极,做电解池的阴极,不失电子,铁被保护;正确答案:负。
Ⅱ. (1)①反应中Fe元素化合价由+2价升高为+6价,被氧化,FeSO4为还原剂,过氧化钠中O元素的化合价由-1价降低为-2价,由-1价升高为0,过氧化钠既是氧化剂也是还原剂,由方程式可以知道,生成2molNa2FeO4,有6molNa2O2参加反应,转移10mol电子,则每生成1molNa2FeO4转移的电子数为5mol;因此,本题正确答案是:Na2O2;FeSO4和Na2O2;5。
②高铁酸钾具有强氧化性,能杀菌消毒;消毒过程中自身被还原为Fe3+,Fe3+水解生成Fe(OH)3胶体能吸附水中悬浮杂质而沉降;正确答案:高铁酸钾具有强氧化性,能杀菌消毒;消毒过程中自身被还原为Fe3+,Fe3+水解生成Fe(OH)3胶体能吸附水中悬浮杂质而沉降。
(2)①湿法制备高铁酸钾(K2FeO4)时,Fe(OH)3失电子被氧化生成K2FeO4,Fe的化合价升高了3价,C1O-作氧化剂被还原生成C1-,氯元素的价态降了2价,根据电子守恒,得到铁元素物质前边系数是2,Cl的前边系数是3,氢氧化铁必须在碱性条件下存在,所以该反应是在碱性条件下进行,该离子反应为2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O;因此,本题正确答案是:2Fe(OH)3+ 3ClO-+ 4OH-=2FeO42—+3Cl-+ 5H2O。
②反应2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O中转移电子是6mol,生成2molFeO42-,每生成1molFeO42-转移3mol电子;若反应过程中转移了0.3mol电子,则还原产物氯离子的物质的量为0.15mol,因此,本题正确答案是:3;0.15mol。
③低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),在溶液中发生了离子的交换使物质的溶解性发生了改变,可能的原因是该温度下K2FeO4的溶解度比Na2FeO4的溶解度小;正确答案:该温度下K2FeO4比Na2FeO4的溶解度小。

【题目】下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。已知:2KMnO4+16HCl―→2KCl+5Cl2↑+2MnCl2+8H2O

对实验现象的“解释或结论”正确的是 ( )
选项 | 实验现象 | 解释或结论 |
A | a处变蓝,b处变红棕色 | 氧化性:Cl2>Br2>I2 |
B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
C | d处立即褪色 | 氯气与水生成了漂白性物质 |
D | e处变红色 | 还原性:Fe2+>Cl- |
A. A B. B C. C D. D