题目内容
3.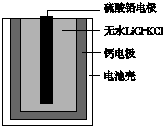 热激活电池可用作火箭、导弹的工作电源.一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能.该电池总反应为PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.下列有关说法正确的是( )
热激活电池可用作火箭、导弹的工作电源.一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能.该电池总反应为PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.下列有关说法正确的是( )| A. | 常温时,在正负极间接上电流表或检流计,指针不偏转 | |
| B. | 放电过程中,Li+向负极移动 | |
| C. | 每转移0.2mol电子,理论上生成41.4gPb | |
| D. | 正极反应式:Ca+2Cl--2e-═CaCl2 |
分析 由原电池总反应可知Ca为原电池的负极,被氧化生成反应H2(g)+Cl2(g)=2HCl(g),反应的电极方程式为Ca+2Cl--2e-=CaCl2,为原电池的正极,发生还原反应,电极方程式为PbSO4+2e-+2Li+=Li2SO4+Pb,原电池工作时,阳离子向正极移动,阴离子向负极移动,结合电解方程式计算.
解答 解:A.常温下,电解质不是熔融态,离子不能移动,不能产生电流,因此连接电流表或检流计,指针不偏转,故A正确;
B.放电过程中阳离子向正极移动,故B错误;
C.根据电极方程式PbSO4+2e-+2Li+=Li2SO4+Pb,可知每转移0.1 mol电子,理论上生成0.05molPb,质量为10.35g,故C错误;
D.正极发生还原反应,电极方程式为PbSO4+2e-+2Li+=Li2SO4+Pb,故D错误;
故选A.
点评 本题考查原电池的工作原理,注意根据总反应式结合物质所含元素化合价的变化判断原电池的正负极,把握电极方程式的书写方法,易错点为D,注意把握原电池的构成条件,题目难度中等.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
13.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 25℃,1.01×105Pa时,32 g O2和O3的混合气体所含原子数为2NA | |
| B. | 含有NA个氦原子的氦气在标准状况下的体积约为11.2L | |
| C. | 标准状况下,11.2LH2O含有的分子数为0.5NA | |
| D. | 在常温常压下,22.4 LCO2含有的原子数约为3NA |
14.不属于人体能够消化吸收的营养物质的是( )
| A. | 糖类、油脂 | B. | 蛋白质、淀粉 | C. | 纤维素 | D. | 水、矿物质 |
11.下列表达式正确的是( )
| A. | NaHCO3的电离:NaHCO3═H++CO32-+Na+ | |
| B. | Na2S的水解:S2-+2H2O?H2S+2OH- | |
| C. | CH3COONH4的电离:CH3COONH4═NH4++CH3COO- | |
| D. | FeCl3的水解:Fe3++3H2O?Fe(OH)3↓+3H+ |
18.下列与实验相关的叙述正确的是( )
| A. | 稀释浓硫酸时,应将蒸馏水沿玻璃棒缓慢注入浓硫酸中 | |
| B. | 碘易溶于酒精,所以用酒精从碘水中萃取碘 | |
| C. | 液溴应保存在磨口玻璃塞试剂瓶中,并加少量水进行水封? | |
| D. | 检验某溶液是否含有SO42- 时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸 |
15.酯A水解得甲醇和羧酸B,酯A的相对分子质量为132,又知羧酸B中氧元素质量分数为61.5%,取一定质量的羧酸B完全燃烧生成CO2和H2O的物质的量之比为3:2.则( )
| A. | 1mol羧酸B在光照条件下最多可与4mol氯气发生取代反应 | |
| B. | l酯A只能在碱性溶液中才能水解 | |
| C. | 1mol酯A最多可与2mol NaOH溶液发生反应 | |
| D. | 题中酸也能燃烧可知有机物均可在氧气中点燃 |