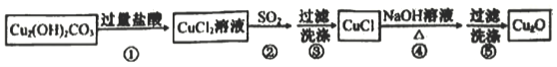题目内容
【题目】某温度下,相同体积、相同pH的氨水和氢氧化钠溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )
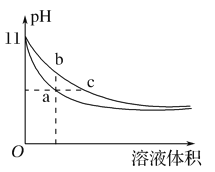
A. a点导电能力比b点强
B. b点的Kw值大于c点
C. 与盐酸完全反应时,消耗盐酸体积Va>Vc
D. a、c两点的c(H+)相等
【答案】D
【解析】根据信息可知氢氧化钠溶液和氨水具有相同的体积和pH,由于氢氧化钠是强电解质,一水合氨是弱电解质,则氢氧化钠的浓度小于氨水,稀释过程中,促进一水合氨电离,所以pH变化大的是氢氧化钠,变化小的是氨水,则A.溶液的导电能力与离子浓度成正比,a点的离子浓度小于b点,所以a点溶液的导电能力比处于b点溶液的导电能力弱,A错误;B.水的离子积常数只与温度有关,温度不变,水的离子积常数不变,B错误;C.等pH的氨水和氢氧化钠,氨水的浓度大于氢氧化钠,等体积的二者,氨水的物质的量大于氢氧化钠,碱的物质的量越大消耗同浓度酸的体积越多,C错误;D.a、c两点的pH相等,则溶液中c(H+)相等,D正确,答案选D。

练习册系列答案
相关题目