题目内容
【题目】充分利用黄铁矿(主要成份为FeS2)对资源和环境具有重要的意义。
(1)一种酸性条件下催化氧化黄铁矿的物质转化关系如下面图Ⅰ所示。
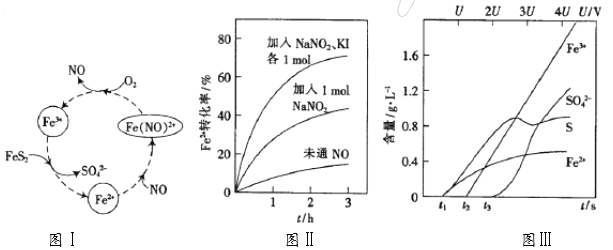
①图Ⅰ中,NO起的是_____作用;O2氧化FeS2生成Fe3+的离子方程式为____________;
②硝酸也可以将FeS2氧化为Fe3+和SO42-,但使用稀硝酸比浓硝酸的反应速率快很多,其原因是:_________。
(2)控制Fe3+的浓度、溶液体积和通入O2的速率一定,图Ⅱ表示当改变其它条件时Fe2+被氧化的转化率随时间的变化。
①加入NaNO2发生反应:3NO2-+2H+==NO3-+2NO↑+H2O。若3molNaNO2完全反应,则转移的电子数为____________________mol。
②在酸性溶液中,加入NaNO2、KI发生反应生成NO和I2,该离子反应方程式为______ ;图Ⅱ中曲线从下至上, Fe2+转化速率依次增大的原因是________。
(3)为研究FeS2作电极时的放电规律,以FeS2作阳极进行电解,由FeS2放电产生的粒子的含量与时间(t)、电压(U)之间的关系如图Ⅲ所示。
①t1至t2间FeS2发生的电极反应式为_________________。
②当电压值介于3.5U~4.4U之间时,FeS2放电所得的主要粒子为_______________。
③黄铁矿含有杂质钴和镍。若电解一段时间,c(Fe3+)=1×10-2mol·L-1时,通过计算判断:pH控制为_______不会产生Fe(OH)3沉淀;当使Co2+沉淀完全时,Fe3+_____(填:“已经”或“没有”)开始沉淀。{已知:离子浓度≤1×10–5mol·L–1认为沉淀完全;Ksp[Fe(OH)3]=3.8×10–38、Ksp[Co(OH)2]=2×10–15, ![]() = – 0.16}
= – 0.16}
【答案】 催化 15O2+4FeS2+2H2O =4Fe3++8SO42-+4H+ 反应后稀硝酸被还原为NO起催化剂作用,浓硝酸被还原为NO2不能起催化剂作用 2 2NO2-+2I-+4H+=I2+2NO↑+2H2O 同量的NaNO2产生催化剂NO的量更多,加快了化学反应速率 FeS2-2e-=Fe2++2S Fe3+、SO42- ≤2.16 【答题空10】已经
【解析】(1)①分析图Ⅰ,Fe2+与NO结合成Fe(NO)2+,Fe(NO)2+与O2反应生成NO和Fe3+,由此可得,NO参与反应,在反应前后没有发生变化,所以NO作催化剂起催化作用;由图Ⅰ可看出O2氧化FeS2生成Fe3+,同时-1价S元素被氧化成+6价生成SO42-,0价O元素被还原成-2价,根据得失电子守恒(化合价升降总数相等)和元素守恒可得离子方程式为:15O2+4FeS2+2H2O =4Fe3++8SO42-+4H+。②硝酸将FeS2氧化为Fe3+和SO42-,但浓硝酸和稀硝酸被还原的产物不同,稀硝酸反应后被还原为NO,浓硝酸被还原为NO2,NO可作催化剂,而NO2不能,所以使用稀硝酸比浓硝酸的反应速率快很多。
(2)①根据反应方程式,NO2-中+3价N元素一部分升为+5价,一部分降为+2价,发生自身氧化还原反应,每3mol NO2-反应,有1mol NO2-作氧化剂2molNO2-作还原剂,则3molNaNO2完全反应转移2mol电子。②在酸性溶液中,加入NaNO2、KI发生反应生成NO和I2,N元素化合价由+3降为+2,I元素化合价由-1升为0,根据得失电子守恒(化合价升降总数相等)和元素守恒可得离子方程式为:2NO2-+2I-+4H+=I2+2NO↑+2H2O;NO可作该反应的催化剂,未通入NO则反应速率很慢,相同量的NaNO2,与KI反应产生催化剂NO的量更多,所以加快了化学反应速率。
(3)分析图Ⅲ:①t1至t2间Fe2+和S的含量增加,所以FeS2发生的电极反应式为:FeS2-2e-=Fe2++2S。②当电压值介于3.5U~4.4U之间时,Fe3+和SO42-含量增加,所以FeS2放电所得的主要粒子为:Fe3+、SO42-。③当Q[Fe(OH)3]≤Ksp[Fe(OH)3]时,不会产生Fe(OH)3沉淀,由Q[Fe(OH)3]=Ksp[Fe(OH)3]得,c(Fe3+)c3(OH-)=Ksp[Fe(OH)3],代入数据得:1×10-2×c3(OH-)=3.8×10–38,解得:c(OH-)=![]() mol·L-1,根据c(H+)c(OH-)=KW,常温下KW=1×10-14,代入数据解得:c(H+)=
mol·L-1,根据c(H+)c(OH-)=KW,常温下KW=1×10-14,代入数据解得:c(H+)=![]() ,pH=-
,pH=- ![]() = -
= - ![]() =2.16,所以pH=2.16时刚好Q[Fe(OH)3]=Ksp[Fe(OH)3],pH≤2.16时不会产生Fe(OH)3沉淀;根据Q[Co(OH)2]=Ksp[Co(OH)2]得,c(Co2+)c2(OH-)=Ksp[Co(OH)2],所以c(OH-)=
=2.16,所以pH=2.16时刚好Q[Fe(OH)3]=Ksp[Fe(OH)3],pH≤2.16时不会产生Fe(OH)3沉淀;根据Q[Co(OH)2]=Ksp[Co(OH)2]得,c(Co2+)c2(OH-)=Ksp[Co(OH)2],所以c(OH-)=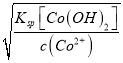 ,当Co2+沉淀完全时,代入相关数据得:c(OH-)=
,当Co2+沉淀完全时,代入相关数据得:c(OH-)= ≥
≥![]() ×10-5 mol·L-1,所以此时Fe3+已经开始沉淀。
×10-5 mol·L-1,所以此时Fe3+已经开始沉淀。