题目内容
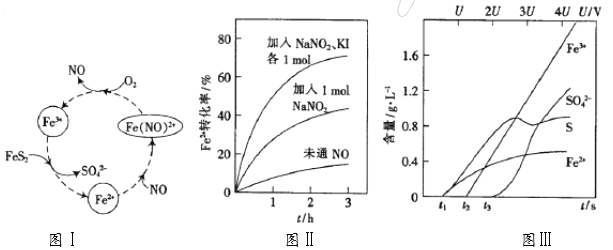
【题目】TiO2在光照射下可使水分解:2H2O![]() 2H2↑+O2↑,该过程类似植物的光合作用。图中是光照射下TiO2分解水的装置示意图。下列叙述正确的是
2H2↑+O2↑,该过程类似植物的光合作用。图中是光照射下TiO2分解水的装置示意图。下列叙述正确的是
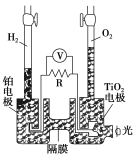
A.该装置可以将光能转化为电能,同时也能将其转化为化学能
B.TiO2电极上发生的反应为:2H++2e-===H2↑
C.该装置工作时,电流由TiO2电极经R流向铂电极
D.该装置工作时,TiO2电极附近溶液的pH变大
【答案】A
【解析】该装置光分解水是将光能转化为化学能,发生氧化还原反应生成氢气和氧气,电子的转移经过R,又将化学能转化为电能;铂电极上生成氢气的反应为2H++2e-===H2↑;TiO2电极上生成氧气的氧化反应,消耗OH-,所以TiO2电极附近溶液的pH减小;电子由TiO2电极经R流向铂电极,电流流动方向相反。

练习册系列答案
相关题目