题目内容
【题目】以下是一些分子的比例模型,其中空间结构和原子大小比例错误的是( )
A.![]() NH3
NH3
B.![]() H2O
H2O
C.![]() HCl
HCl
D. CCl4
CCl4
【答案】D
【解析】解:A、氨气分子为三角锥型结构,由于H原子只有一个电子层,而N原子有两个电子层,故H原子半径小于N原子,故氨气的比例模型为 ![]() ,故A正确; B、水分子为V型结构,由于H原子只有一个电子层,而O原子有两个电子层,故H原子半径小于O原子,故水的比例模型为
,故A正确; B、水分子为V型结构,由于H原子只有一个电子层,而O原子有两个电子层,故H原子半径小于O原子,故水的比例模型为 ![]() ,故B正确;
,故B正确;
C、由于H原子只有一个电子层,而氯原子有3个电子层,故HCl分子中的H原子半径小于Cl原子半径,即HCl的比例模型为 ![]() ,故C正确;
,故C正确;
D、四氯化碳为正四面体结构,但由于C原子有2个电子层,而氯原子有3个电子层,故氯原子半径大于C原子,故四氯化碳的比例模型为 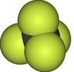 ,故D错误.
,故D错误.
故选D.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目