题目内容
【题目】铜及其化合物具有广泛的应用。回答下列问题:
(1)CuSO4和Cu(NO3)2中阳离子的基态核外电子排布式为__________,S、O、N三种元素的第一电离能由大到小的顺序为___________________。
(2)Cu(NO3)2溶液中通入足量NH3能生成配合物[Cu(NH3)4](NO3)2。其中NH3中心原子的杂化轨道类型为________,[Cu(NH3)4](NO3)2中存在的化学键除了极性共价键外,还有___________。
(3)CuSO4溶液中加入过量KCN能生成配离子[Cu(CN)4]2-,1mol CN中含有的π键数目为_____________。与CN-互为等电子体的离子有_________(写出一种即可)。
(4)CuSO4的熔点为560℃,Cu(NO3)2的熔点为115℃,CuSO4熔点更高的原因可能是_______________________________。

(5)已知Cu2O晶胞结构如图所示:该晶胞原子坐标参数A为(0,0,0);B为(1,0,0);c为![]() 。则D原子的坐标参数为__________,它代表_________原子(填元素符号)。
。则D原子的坐标参数为__________,它代表_________原子(填元素符号)。
(6)金属铜是面心立方最密堆积方式,则晶体中铜原子的配位数是_______,该晶胞中Cu原子的空间利用率是__________。
【答案】 1s22s22p63s23p63d9或[Ar]3d9 N>O>S sp3 配位键、离子键 2NA C22- CuSO4和Cu(NO3)2均为离子晶体,SO42-所带电荷比NO3-大,故CuSO4晶格能较大,熔点较高 (![]() ,
, ![]() ,
, ![]() ) Cu 12 74%
) Cu 12 74%
【解析】(1)CuSO4和Cu(NO3)2中阳离子均是铜离子,其基态核外电子排布式为 [Ar]3d9 或 ls22s22p63s23p63d9;非金属性越强,第一电离能越大,但氮元素的2p轨道电子处于半充满状态,稳定性强,则S、O、N三种元素的第一电离能由大到小的顺序为N>O>S。(2)氨气分子中N原子的价层电子对数是4,且不存在一对孤对电子,因此中心原子的杂化轨道类型为sp3杂化;[Cu(NH3)4]NO3)2中存在的化学键类型除了极性共价键外,还有离子键和配合物。(3)氮气与CN-互为等电子体,分子中含有三键,则lmol CN-中含有的π键的数目为2NA或2×6.02×1023。原子数和价电子数分别都相等的互为等电子体,与CN-互为等电子体的离子有C22-;(4)由于CuSO4和Cu(NO3)2均为离子晶体,SO42-所带电荷比NO3-大,故CuSO4晶格能较大,所以硫酸铜熔点较高。(5)①根据晶胞结构并参照A、B、C原子的原子坐标参数可知D原子的坐标参数为(![]() ,
, ![]() ,
, ![]() )。D代表的原子均位于内部,共计4个,而白球表示的原子个数=1+8×1/8=2,因此D代表Cu原子。②已知金属铜的堆积方式是面心立方最密堆积,则晶体中铜原子的配位数是12。晶胞中铜原子个数是8×1/8+6×1/2=4。设铜原子的半径是r,则面对角线是4r,立方体的边长是
)。D代表的原子均位于内部,共计4个,而白球表示的原子个数=1+8×1/8=2,因此D代表Cu原子。②已知金属铜的堆积方式是面心立方最密堆积,则晶体中铜原子的配位数是12。晶胞中铜原子个数是8×1/8+6×1/2=4。设铜原子的半径是r,则面对角线是4r,立方体的边长是![]() ,则立方体的面积是(
,则立方体的面积是(![]() )3,因此该晶胞中Cu原子的空间利用率是
)3,因此该晶胞中Cu原子的空间利用率是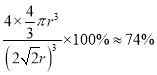 。
。

 导学全程练创优训练系列答案
导学全程练创优训练系列答案【题目】亚硫酸盐在工业生产中冇广泛的应用,某同学在实验中对亚硫酸盐的制备和性质进行探究。
(1)Cu2SO3·CuSO32H2O是一种深红色固体,不溶于水和乙醇,100℃时发生分解,其制备实验装置如图所示。
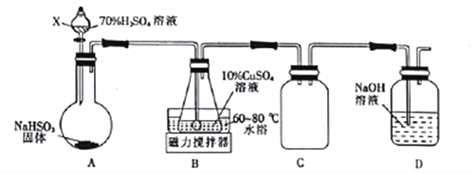
①仪器X的名称是________。常温下用装置A制取SO2时,用较浓的硫酸而不用稀硫酸,其原因是____________________。
②装置C的作用是________________________。
③装置B中发生反应的离子方程式为_____________________。
④从装置B中获得的固体需先用蒸馏水充分洗涤,再真空干燥,而不直接用烘干的方式得到产品,其原因是_________________________。
(2)向NaHSO3溶液中加入NaClO溶液时,反应有三种可能的情况:
I.NaHSO3和NaClO恰好反应;II.NaHSO3过量;III.NaClO过量。甲同学欲通过下列实验确定该反应属于哪一种情况,请完成下表:
实验操作 | 预期现象及结论 |
取上述反应后的混合溶液于试管 A中,滴加稀硫酸 | 若有气泡产生,则_①__(填“I”“II”或“III”,下同)成立,若没有气泡产生,则_②___成立 |
另取上述反应后的混合溶液于试管B中,滴加几滴淀粉KI溶液, 充分振荡 | ③___,则III成立 |
(3)请设计简单实验方案比较室温下NaHSO3浓液中HSO3-的电离平衡常数Ka与水解平衡常数Kb的相对大小:________________________。

