题目内容
12.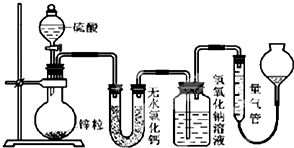 不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气.为了验证这一事实,某同学拟用如图装置进行实验(实验时压强为10lkPa,温度为0℃).
不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气.为了验证这一事实,某同学拟用如图装置进行实验(实验时压强为10lkPa,温度为0℃).(1)若在烧瓶中放入1.30g锌粒,与cmol/LH2SO4反应,为保证实验结论的可靠,量气管的适宜规格是C(以序号作答).
A.200mL B.400mL C.500mL
(2)若1.30g锌粒完全溶解,氢氧化钠洗气瓶增重l.28g,则圆底烧瓶中发生反应的化学方程式为:Zn+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ZnSO4+SO2↑+2H2O.
(3)若烧瓶中投入a g锌且完全反应,氢氧化钠洗气瓶增重b g.量气瓶中收集到VmL气体,请写出a、b、v的代数关系式:$\frac{ag}{65g/mol}$=$\frac{bg}{64g/mol}$+$\frac{VL}{22.4mL/mol}$:
(4)若在烧瓶中投入dg锌,加入一定量的cmol/L浓硫酸VL,充分反 应后锌有剩余,测得氢氧化钠洗气瓶增重mg,则整个实验过程产生的气体中,$\frac{n({H}_{2})}{n(S{O}_{2})}$=$\frac{64cV-2m}{m}$(用含字母的代数式表示).若撤走盛有无水氯化钙的U型管,$\frac{n({H}_{2})}{n(S{O}_{2})}$的数值将偏小(填偏大、偏小或无影响)
(5)反应结束后,为了准确地测量气体体积,量气管在读数时应注意:①待冷却至室温才开始读数②读数前使量气管左右液面相平③视线与量气管中液面的凹液面最低点在同一水平面.
分析 (1)根据锌的质量计算生成气体的体积,从而确定量气管的适宜规格;
(2)根据氢氧化钠的性质分析增重的原因,并写出相应的化学反应方程式;
(3)根据氧化还原反应的特点分析,1 mol锌无论用来产生SO2 还是产生氢气都是1 mol锌对应1 mol气体;
(4)根据氢氧化钠洗气瓶增重的量求出反应的硫酸的物质的量,硫酸总量减去生成二氧化硫需要的硫酸的量即为生成氢气的硫酸的量,继而求出生成气体的物质的量;根据无水氯化钙的作用分析;
(5)①根据化学反应与反应热的关系分析;②根据溶液的读数方法分析;③视线的位置分析.
解答 解:(1)设生成的氢气体积为xL,
Zn+H2SO4=ZnSO4+H2↑
1mol 22.4L
$\frac{1.30g}{65g/mol}$=0.02mol x
则x=0.448L=448mL,则量气管的规格应该选500mL,
故答案为:C;
(2)氢氧化钠是碱,能吸收酸性气体,氢氧化钠洗气瓶增重说明有酸性气体生成,当锌和硫酸反应时,锌作还原剂,硫酸作氧化剂,被还原为二氧化硫,由(1)计算可知,1.30g锌和硫酸反应若只生成二氧化硫,共生成0.02mol,质量为0.02mol×64g/mol=1.28g,与氢氧化钠增重的质量一致,故发生反应的化学方程式为:Zn+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ZnSO4+SO2↑+2H2O,
故答案为:Zn+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ZnSO4+SO2↑+2H2O;
(3)根据氧化还原知识或根据方程式,1 mol锌无论用来产生SO2 还是产生氢气,都是1mol锌对应1 mol气体,根据氧化还原反应中得失电子数相等可得:$\frac{ag}{65g/mol}$=$\frac{bg}{64g/mol}$+$\frac{VL}{22.4mL/mol}$,
故答案为:$\frac{ag}{65g/mol}$=$\frac{bg}{64g/mol}$+$\frac{VL}{22.4mL/mol}$;
(4)Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O
2mol 1mol
$\frac{m}{32}$mol $\frac{m}{64}$mol
则生成二氧化硫需要的硫酸为$\frac{m}{32}$mol;
Zn+H2SO4=ZnSO4+H2↑
1mol 1mol
( cV-$\frac{m}{32}$)mol (cV-$\frac{m}{32}$)mol
则:$\frac{n(H{\;}_{2})}{n(SO{\;}_{2})}$=$\frac{(cV-\frac{m}{32})mol}{\frac{m}{64}mol}$=$\frac{64cV-2m}{m}$;
若撤走盛有无水氯化钙的U型管,混合气体中的水蒸气进入氢氧化钠溶液,导致洗气瓶增重量增大,所以计算时二氧化硫的物质的量增大,氢气与二氧化硫的物质的量之比偏小,
故答案为:$\frac{64cV-2m}{m}$;偏小;
(5)因为该反应是放热反应,随着反应的进行,溶液的温度逐渐升高,生成的气体温度高于标况下温度,温度对气体体积有影响,所以要待冷却至室温才开始读数;在读数时,如果俯视或仰视都会造成误差,所以读数时眼睛视线与液面最低处相平,
故答案为:①待冷却至室温才开始读数;②读数前使量气管左右液面相平;③视线与量气管中液面的凹液面最低点在同一水平面.
点评 本题考查了浓硫酸的性质,题目难度中等,明确发生反应原理为解答关键,注意掌握电子守恒在化学计算中的应用,试题侧重考查学生的分析、理解能力及化学实验能力.

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案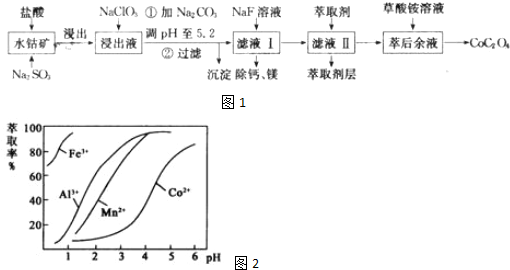
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3的目的是将Fe3+、Co3+(填离子符号)还原,若只用盐酸浸取,则会产生污染空气的有毒气体,反应的离子方程式为2Co3++2Cl-=Cl2 ↑+2Co2+.
(2)向浸出液中加入NaClO3的作用是将Fe2+氧化成Fe3+,反应的离子方程式为ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O.
(3)浸出液中加Na2CO3调pH至5.2时生成的沉淀为Fe(OH)3、Al(OH)3(填化学式),能够生成此沉淀的原因是铝离子、铁离子能与碳酸根离子发生双水解生成沉淀和二氧化碳,反应的离子方程式为:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2、2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑(用离子方程式结合必要的文字说明).
(4)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀.已知KSp( MgF2)=7.35
×10-ll、Ksp( CaF2)=1.05×10-10,当加入过量NaF后,所得滤液中$\frac{c(M{g}^{2+})}{c(C{a}^{2+})}$=0.7
(5)滤液Ⅱ中加入萃取剂的作用是除去溶液中的Mn2+,萃取剂对金属离子的萃取率与pH的关系如图2所
示.使用萃取剂适宜的pH是B(填字母).
a.接近2.0
b.接近3.0
c.接近4.0.
 镍及其化合物常用作合金、催化剂及电极材料.已知:镍元素有+2、+3价的氧化物和氢氧化物,在盐中以+2价的形式存在.
镍及其化合物常用作合金、催化剂及电极材料.已知:镍元素有+2、+3价的氧化物和氢氧化物,在盐中以+2价的形式存在.(1)镍与稀硝酸反应放出NO,反应的化学方程式是3Ni+8HNO3=3Ni(NO3)2+2NO↑+4H2O.
(2)Ni2O3是一种重要的电池材料.
①铁镍蓄电池放电时总反应为:Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2
电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2;
电池充电时,阳极反应为2Ni(OH)2+2OH--2e-=Ni2O3+6H2O.
②在碱性条件下,镍氢电池的总反应为:3Ni2O3+LaNi5H6+3H2O$?_{充电}^{放电}$LaNi5+6Ni(OH)2,该电池放电时,负极电极反应为LaNi5H6+6OH--6e-=LaNi5+6H2O
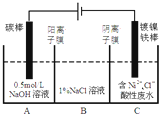
(3)工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示.
已知:
①Ni2+在弱酸性溶液中发生水解
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)
下列说法不正确的是BD
A.碳棒上发生的电极反应:4OH--4e- O2↑+2H2O
B.电解过程中,B室中NaCl溶液的物质的量浓度将不断减少
C.为了提高Ni的产率,电解过程中需要控制废水pH
D.若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式不发生改变
(4)某工厂用废的含镍催化剂(主要含Ni,还含有一定量的Al、Fe、SiO2)回收镍的流程如下:

已知:上述流程中,几种氢氧化物完全沉淀时的pH如下表:
| 沉淀 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 9.2 |
②滤渣b所含成份的化学式为Al(OH)3、Fe(OH)3.
③若将溶液调整为pH=6时加入了bkgNi(OH)2,从酸浸到滤液B的过程中镍的损失率为3%,后几步操作过程中镍的损失率为5%,akg废催化剂(含Ni70%)经上述流程最终得到金属镍的质量为(a×70%×97%+$\frac{59}{93}$b)×95%kg(填计算式).
| A. | K值越大,表明该反应速率越快,反应物的转化率也越大 | |
| B. | 若缩小反应器的容积,能使平衡正向移动,则K增大 | |
| C. | 温度相同,K值也一定相同 | |
| D. | pC(g)?mA(g)+nB(g) 的平衡常数与K互为相反数 |
| A. | 0.1 mol•L-1的Na2CO3溶液:K+、Ba2+、NO${\;}_{3}^{-}$、Cl- | |
| B. | 0.1 mol•L-1FeCl3溶液:K+、NH${\;}_{4}^{+}$、I-、OH- | |
| C. | pH=1的溶液:S2-、NH4+、Cl-、Na+ | |
| D. | 能使酚酞变红的溶液中:K+、Na+、SO${\;}_{4}^{2-}$、CH3COO- |
| A. | Cl2+H2O?HCl+HClO | B. | FeCl3+3KSCN?Fe(SCN)3+3KCI | ||
| C. | MgCl2+2H2O?Mg(OH)2+2HCl | D. | K2CO3+H2O?KHCO3+KOH |
| A. | 铁与稀硫酸反应后的溶液中:[Fe(CN)6]3-、NH${\;}_{4}^{+}$、Cl-、NO${\;}_{3}^{-}$ | |
| B. | 澄清石灰水中:Na+、K+、CH3COO -、HCO${\;}_{3}^{-}$ | |
| C. | c(H+)=10-13mol/L的溶液中:NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$、K+、Na+ | |
| D. | 空气中:SO2、NO、N2、NH3 |