题目内容
17.常温下,下列各组离子在指定溶液中一定能大量共存的是( )| A. | 0.1 mol•L-1的Na2CO3溶液:K+、Ba2+、NO${\;}_{3}^{-}$、Cl- | |
| B. | 0.1 mol•L-1FeCl3溶液:K+、NH${\;}_{4}^{+}$、I-、OH- | |
| C. | pH=1的溶液:S2-、NH4+、Cl-、Na+ | |
| D. | 能使酚酞变红的溶液中:K+、Na+、SO${\;}_{4}^{2-}$、CH3COO- |
分析 A.钡离子与碳酸钠反应生成碳酸钡沉淀;
B.氯化铁与碘离子、氢氧根离子反应;
C.pH=1的溶液为酸性溶液,硫离子与酸性溶液中的氢离子反应;
D.能使酚酞变红的溶液中存在大量氢氧根离子,四种离子之间不反应,都不与氢氧根离子反应.
解答 解:A.Na2CO3、Ba2+之间反应生成碳酸钡沉淀,在溶液中不能大量共存,故A错误;
B.FeCl3与I-、OH-发生反应,在溶液中不能大量共存,故B错误;
C.pH=1的溶液中存在大量氢离子,S2-与氢离子反应,在溶液中不能大量共存,故C错误;
D.能使酚酞变红的溶液为碱性溶液,溶液中存在大量氢氧根离子,K+、Na+、SO42-、CH3COO-之间不反应,都不与氢氧根离子反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的正误判断,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案
相关题目
7.将相同的物质的量浓度的某弱酸HX溶液与NaX溶液人等体积混合后,测得混合后溶液中c(Na+)>c (X-),则下列关系错误的是( )
| A. | c (H+)<c (OH-) | B. | c (HX )<c (X-) | ||
| C. | c (X-)+c(HX )=2c (Na+) | D. | c (X-)-c (HX)═2(c( OH-)-c (H+)) |
8.为测定一置于空气中的某硫酸酸化的FeSO4溶液中Fe2+被氧化的百分率,某同学准确量取pH=1(忽略Fe2+、Fe3+的水解)的FeSO4溶液200mL,加入过量BaCl2溶液,充分反应后过滤、洗涤、干燥,得到沉淀28.0g;再另取同样的FeSO4溶液200mL,向其中加入过量NaOH溶液,搅拌使其充分反应,待沉淀全部变为红褐色后,过滤、洗涤并灼烧所得固体,最终得固体8.0g.
(1)写出反应中涉及的化学方程式(至少3个)
(2)通过计算,填写下表:
注:c(Fe2+、Fe3+)表示Fe2+和Fe3+的总的物质的量的浓度
(3)计算原溶液中Fe2+被氧化的百分率.
(1)写出反应中涉及的化学方程式(至少3个)
(2)通过计算,填写下表:
| c(H+) | c(SO42-) | c(Fe2+、Fe3+) |
(3)计算原溶液中Fe2+被氧化的百分率.
5.环境污染已严重危害人类的生活.将对应的选项的字母填入下表中
A.氟利昂 B.SO2C.NO2D.CO2
A.氟利昂 B.SO2C.NO2D.CO2
| 环境问题 | 造成环境问题的主要物质 |
| 温室效应 | |
| 酸雨 | |
| 南极臭氧层空洞 | |
| 光化学烟雾 |
7.下列叙述错误的是( )
| A. | 置换反应一定是氧化还原反应 | |
| B. | 二氧化碳是非电解质 | |
| C. | 等质量的二氧化硫和氨气,前者体积大 | |
| D. | 坩埚、试管、蒸发皿都可以用酒精灯直接加热 |
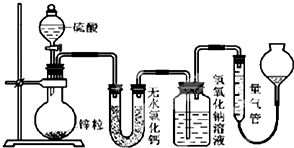 不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气.为了验证这一事实,某同学拟用如图装置进行实验(实验时压强为10lkPa,温度为0℃).
不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气.为了验证这一事实,某同学拟用如图装置进行实验(实验时压强为10lkPa,温度为0℃).