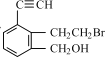
题目内容
【题目】在人类文明的历程中,改变世界的事物很多,其中铁、硝酸钾、青霉素、氨、乙醇、二氧化碳等17种“分子”改变过人类的世界。
(1)铁原子在基态时,价层电子排布式为___。
(2)硝酸钾中NO3-的空间构型为___。
(3)1molCO2分子中含有σ键的数目为___。乙醇的相对分子质量比氯乙烷小,但其沸点比氯乙烷高,其原因是___。
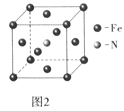
(4)6-氨基青霉烷酸的结构如图1所示,其中采用sp3杂化的原子有___。
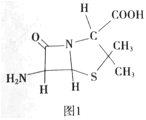
(5)铁和氨气在640℃可发生置换反应,产物之-的晶胞结构如图2所示,写出该反应的化学方程式___。
(6)晶胞有两个基本要素:
①原子坐标参数:表示晶胞内部各微粒的相对位置。如图是CaF2的晶胞,其中原子坐标参数A处为(0,0,0);B处为(![]() ,
,![]() ,0);C处为(1,1,1)。则D处微粒的坐标参数为___。
,0);C处为(1,1,1)。则D处微粒的坐标参数为___。
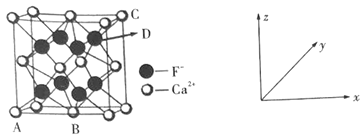
②晶胞参数:描述晶胞的大小和形状。已知CaF2晶体的密度为ρg·cm-3,则晶胞参数a为___pm(设NA为阿伏加德罗常数的值,用含ρ、NA的式子表示)。
【答案】3d64s2 平面正三角形 2 乙醇分子间可形成氢键,氯乙烷中不含氢键,氢键的存在导致乙醇的沸点升高,所以乙醇的沸点比氯乙烷高 C、N、O、S 8Fe+2NH3=2Fe4N+3H2 (3/4,3/4,3/4) 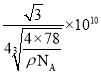
【解析】
(1)铁是26号元素,基态原子核外有26个电子,3d、4s能级上电子是其价电子,根据构造原理书写其基态价电子排布式;
(2)根据价层电子对互斥理论确定离子空间构型;
(3)依据二氧化碳的结构进行回答;
(4)根据价层电子对互斥理论确定碳原子杂化方式;
(5)铁和氨气在640℃可发生置换反应生成氮气和氮化铁,利用均摊法确定氮化铁的化学式,根据温度、反应物和生成物写出反应方程式.
(6)①D处于体对角线AC上,且AD距离等于体对角线长度的![]() ,则D到坐标平面距离均为晶胞棱长
,则D到坐标平面距离均为晶胞棱长![]() ;
;
②晶胞中Ca2+与离它最近的F-之间的距离等于晶胞体对角线长度的![]() ,体对角线长度等于晶胞棱长的√3倍,均摊法计算晶胞中各原子数目,计算晶胞质量,结合密度计算晶胞体积,晶胞体积开三次方得到晶胞棱长。
,体对角线长度等于晶胞棱长的√3倍,均摊法计算晶胞中各原子数目,计算晶胞质量,结合密度计算晶胞体积,晶胞体积开三次方得到晶胞棱长。
(1)铁是26号元素,基态原子核外有26个电子,3d、4s能级上电子是其价电子,根据构造原理知其价电子排布式为:3d64s2,
故答案为:3d64s2;
(2)NO3-中N原子价层电子对=1/2(5+1-3×2)=3,且不含孤电子对,所以是平面三角形结构,
故答案为:平面正三角形;
(3)二氧化碳的结构是O=C=O,含有的σ键的数目为2,乙醇的相对分子质量比氯乙烷小,但其沸点比氯乙烷高,其原因是乙醇分子间可形成氢键,氯乙烷中不含氢键,氢键的存在导致乙醇的沸点升高,所以乙醇的沸点比氯乙烷高,;
故答案为:2;乙醇分子间可形成氢键,氯乙烷中不含氢键,氢键的存在导致乙醇的沸点升高,所以乙醇的沸点比氯乙烷高;
(4)只要共价单键和孤电子对的和是4的原子就采取sp3杂化,根据图片知,采用sp3杂化的原子有C、N、O、S,
故答案为:C、N、O、S;
(5)该晶胞中铁原子个数=8×![]() +6×
+6×![]() =4,氮原子个数是1,所以氮化铁的化学式是Fe4N,铁和氨气在640℃可发生置换反应生成氮气和氮化铁,所以该反应方程式为:8Fe+2NH3=2Fe4N+3H2,
=4,氮原子个数是1,所以氮化铁的化学式是Fe4N,铁和氨气在640℃可发生置换反应生成氮气和氮化铁,所以该反应方程式为:8Fe+2NH3=2Fe4N+3H2,
故答案为:8Fe+2NH3=2Fe4N+3H2.
(6)①D处于体对角线AC上,且AD距离等于体对角线长度的34,则D到坐标平面距离均为晶胞棱长3/4,由C的坐标参数可知,晶胞棱长=1,故D到坐标平面距离均3/4,D处微粒的坐标参数为(![]() ,
, ![]() ,
,![]() ),
),
故答案为:(![]() ,
,![]() ,
,![]() );
);
②设晶胞中Ca2+与离它最近的F-间距离为xnm,晶胞的边长为ycm,则x与y的关系为(4x)2=3y2,所以y=![]() 。由于F-位于晶胞的内部,Ca2+位于晶胞的顶点和面心,所以平均每个晶胞含有F-和Ca2+数目分别是8个和4个,所以ρ=
。由于F-位于晶胞的内部,Ca2+位于晶胞的顶点和面心,所以平均每个晶胞含有F-和Ca2+数目分别是8个和4个,所以ρ=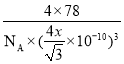 ,解得x=
,解得x=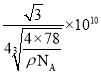 ,
,
故答案为: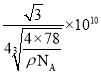 。
。

【题目】A、B、C为短周期元素,它们的位置关系如图所示,已知B、C两元素原子序数之和是A元素的原子序数的4倍。
A | ||
B | C |
(1)A、B、C的元素名称分别为A______、B______、C_____。
(2)A的原子结构示意图为________。
(3)B在元素周期表中的位置是_______,B最高价氧化物的化学式为______。
(4)A的简单氢化物分子式为_______;B、C的最高价氧化物水化物的分子式分别为____、____。
【题目】(1)某种苯的同系物0.1mol在足量的氧气中完全燃烧,将产生的高温气体依次通过浓硫酸和氢氧化钠溶液,使浓硫酸增重9g,氢氧化钠溶液增重35.2g。实践中可根据核磁共振氢谱(PMR)上观察到氢原子给出的峰值情况,确定有机物的结构。此含有苯环的有机物,在PMR谱上峰给出的稳定强度仅有四种,它们分别为:①3∶1∶1 ②1∶1∶2 ∶6 ③3∶2 ④3∶2∶2∶2∶1 ,请分别推断出其对应的结构:
①_______________________________; ②______________________________;
③_______________________________; ④______________________________。
(2)下表中括号内物质为所含的少量杂质,请选用适当的试剂和分离装置将杂质除去,并将所选的试剂及装置的编号填入表中。
试剂:①水; ②氢氧化钠; ③溴水; ④酸性高锰酸钾
分离装置:A.分液装置; B.蒸馏装置; C.洗气装置;
需加入的试剂 | 分离装置 | |
乙烷(乙烯) | __________________ | __________________ |
乙醇(乙酸) | __________________ | __________________ |