题目内容
再体积恒定的密闭容器中,一定量的SO2与1.100mol O2在催化剂作用下加热到600℃发生反应: 当气体的物质的量减少0.315mol时反应达到平衡,在相同的温度下测得气 体压强为反应前的82.5%。下列有关叙述正确的是( )
当气体的物质的量减少0.315mol时反应达到平衡,在相同的温度下测得气 体压强为反应前的82.5%。下列有关叙述正确的是( )
当SO3的生成速率与SO2的消耗速率相等时反应达到平衡
降低温度,正反应速率减小程度比逆反应速率减小程度大
将平衡混合气体通入过量BaCl2溶液中,得到沉淀的质量为161.980g
达到平衡时,SO2的转化率是90%
 当气体的物质的量减少0.315mol时反应达到平衡,在相同的温度下测得气 体压强为反应前的82.5%。下列有关叙述正确的是( )
当气体的物质的量减少0.315mol时反应达到平衡,在相同的温度下测得气 体压强为反应前的82.5%。下列有关叙述正确的是( )当SO3的生成速率与SO2的消耗速率相等时反应达到平衡
降低温度,正反应速率减小程度比逆反应速率减小程度大
将平衡混合气体通入过量BaCl2溶液中,得到沉淀的质量为161.980g
达到平衡时,SO2的转化率是90%
D
试题分析:A、SO3的生成速率与SO2的消耗速率都表示正反应速率,反应始终相等,不能说明到达平衡,错误;B、降低温度,正、逆反应速率都减小,该反应正反应是放热反应,降低温度平衡向正反应移动,逆反应速率减小程度更大,错误;C、混合气体通入通入过量BaCl2溶液中,得到沉淀为硫酸钡,平衡时气体的物质的量减少0.315mol,则:
2SO2+O2
 2SO3物质的量减少△n
2SO3物质的量减少△n2 1
n(SO3) 0.315mol
所以n(SO3)=2×0.315mol=0.63mol,根据硫元素守恒有n(BaSO4)=n(SO3)=0.63mol,所以生成的硫酸钡的质量为0.63mol×233g/mol=146.79g,错误;D、令开始加入的SO2为amol,利用压强之比等于物质的量之比,则:(a+1.1)mol×82.5%=(a+1.1-0.315)mol,解得a=0.7,平衡时气体的物质的量减少0.315mol,则:
2SO2+O2
 2SO3物质的量减少△n
2SO3物质的量减少△n2 1
n(SO2) 0.315mol
所以n(SO2)=2×0.315mol=0.63mol,故二氧化硫的转化率为0.63mol÷0.7mol×100%=90%, 正确。

练习册系列答案
相关题目


 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表: 


 FeO(s)+CO(g) ΔH1=akJ·mol一
FeO(s)+CO(g) ΔH1=akJ·mol一
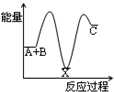
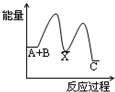
 B、C的物质的量随时间变化的关系如图l,达平衡后在
B、C的物质的量随时间变化的关系如图l,达平衡后在 时都只改变了一种条件,逆反应速率随时间变化的关系如图2。下列有关说法正确的是
时都只改变了一种条件,逆反应速率随时间变化的关系如图2。下列有关说法正确的是
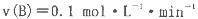

 30S内,NO增加了0.3mol,则在30S内,该反应的平均反应速率正确的是
30S内,NO增加了0.3mol,则在30S内,该反应的平均反应速率正确的是