题目内容
一定温度下,在2L的密闭容器中发生如下反应: B、C的物质的量随时间变化的关系如图l,达平衡后在
B、C的物质的量随时间变化的关系如图l,达平衡后在 时都只改变了一种条件,逆反应速率随时间变化的关系如图2。下列有关说法正确的是
时都只改变了一种条件,逆反应速率随时间变化的关系如图2。下列有关说法正确的是

A.x=2,反应开始2 min内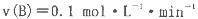
B.t1时是降温,平衡逆向移动
C.t2时改变的条件可能是增大c(C),平衡时B的物质的量分数增大
D.t3时可能是减小压强,平衡不移动;t4时可能是使用催化剂,c (B)不变
 B、C的物质的量随时间变化的关系如图l,达平衡后在
B、C的物质的量随时间变化的关系如图l,达平衡后在 时都只改变了一种条件,逆反应速率随时间变化的关系如图2。下列有关说法正确的是
时都只改变了一种条件,逆反应速率随时间变化的关系如图2。下列有关说法正确的是
A.x=2,反应开始2 min内
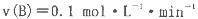
B.t1时是降温,平衡逆向移动
C.t2时改变的条件可能是增大c(C),平衡时B的物质的量分数增大
D.t3时可能是减小压强,平衡不移动;t4时可能是使用催化剂,c (B)不变
D
试题分析:A、由图1可知B物质的量减少0.2mol,C的物质的量增加0.2mol,所以x=2;反应开始2 min内B的浓度减少0.2mol/2L=0.1mol/L,则v(B)=0.1mol/L/2min=0.05mol/(L·min),错误;B、t1时逆反应速率迅速减小,随后又增大,说明平衡正向移动,改变的条件可能是减少C的浓度,不可能是降温,因为降温是反应速率逐渐减小,错误;C、t2时逆反应速率迅速增大,随后减小,说明平衡逆向移动,改变的条件可能是增大C的浓度,平衡时的B物质的量浓度增大,但该反应是反应前后气体物质的量不变的反应,C浓度增大而达到的平衡与原平衡是等效的,所以B的物质的量分数不变,错误;D、t3时逆反应速率迅速减小,且保持不变,说明平衡未移动,改变的条件可能是扩大容器的体积,压强减小,反应速率减小,但压强对该反应的平衡无影响;t4时逆反应速率迅速增大且保持不变,平衡不移动,可能是使用催化剂,平衡不移动,c (B)不变,正确,答案选D。

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目
 C(s)+4D(g) ΔH<0,下图中a、b表示一定条件下,D的体积分数随时间t的变化情况。若要使曲线b变为曲线a,可采取的措施是( )
C(s)+4D(g) ΔH<0,下图中a、b表示一定条件下,D的体积分数随时间t的变化情况。若要使曲线b变为曲线a,可采取的措施是( )
 当气体的物质的量减少0.315mol时反应达到平衡,在相同的温度下测得气 体压强为反应前的82.5%。下列有关叙述正确的是( )
当气体的物质的量减少0.315mol时反应达到平衡,在相同的温度下测得气 体压强为反应前的82.5%。下列有关叙述正确的是( ) (NH4)2CO3(aq) ΔH1
(NH4)2CO3(aq) ΔH1


 CO2(g)+H2(g)(ΔH>0),若温度越高,则v(CO)越大
CO2(g)+H2(g)(ΔH>0),若温度越高,则v(CO)越大 2Na2CO3(1)+C(s,金刚石);△H=-1080.9kJ/mol
2Na2CO3(1)+C(s,金刚石);△H=-1080.9kJ/mol

 、
、

 。
。