题目内容
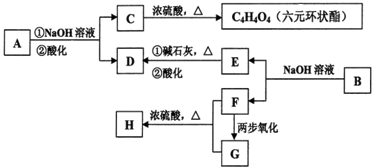
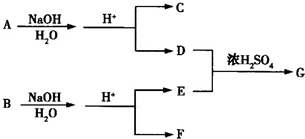
化合物A、B均是分子式为C8H8O3的无色液体,均难溶于水.从A、B开始,可发生图示的一系列反应(反应中的无机物已全部略去),E的苯环上的一氯代物只有两种.H、G均可发生银镜反应. 已知:C6H5-COONa+NaOH
C6H6+Na2CO3
(1)写出结构简式:A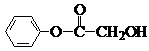
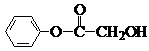 、B
、B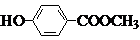
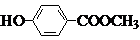 ;
;
(2)H和G中含有相同的官能团,该官能团的名称
(3)写出C→C4H4O4反应的化学方程式:
(4)D的溶液与过量浓溴水反应的化学方程式为: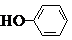 +3Br2---→
+3Br2---→ +3HBr
+3HBr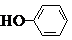 +3Br2---→
+3Br2---→ +3HBr;
+3HBr;
(5)化学式仍为C8H8O3,能发生银镜反应,且苯环上的一氯代物仅有一种的所有同分异构体的结构简式:
 ,
,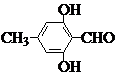
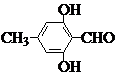 ;
;
(6)F与氧气构成燃料电池的两极,用NaOH溶液做电解质溶液.请写出负极的电极方程式:
| ||
| △ |

(1)写出结构简式:A
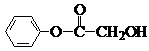
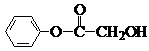
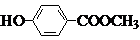
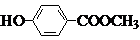
(2)H和G中含有相同的官能团,该官能团的名称
醛基
醛基
;(3)写出C→C4H4O4反应的化学方程式:
2HOCH2COOH
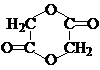 +H2O
+H2O
| ||
| △ |
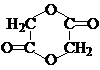 +H2O
+H2O2HOCH2COOH
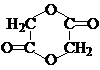 +H2O
+H2O
;
| ||
| △ |
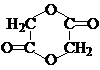 +H2O
+H2O(4)D的溶液与过量浓溴水反应的化学方程式为:
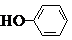 +3Br2---→
+3Br2---→ +3HBr
+3HBr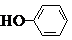 +3Br2---→
+3Br2---→ +3HBr
+3HBr(5)化学式仍为C8H8O3,能发生银镜反应,且苯环上的一氯代物仅有一种的所有同分异构体的结构简式:


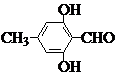
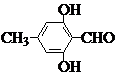
(6)F与氧气构成燃料电池的两极,用NaOH溶液做电解质溶液.请写出负极的电极方程式:
CH3OH-6e-+8OH-═CO32-+6H2O
CH3OH-6e-+8OH-═CO32-+6H2O
.分析:从正向看,A在碱性条件下能发生水解,应是酯,它在碱性条件下水解生成羧酸盐和醇,根据生成的六元环状酯,说明C中既含有羧基,又含有羟基,应为HOCH2COOH,从逆向生成H的条件看,可推知H也是酯,由H、G均可发生银镜反应,所以可推知F是甲醇,G应是甲酸.再根据苯制取的原理和E与碱石灰共热生成D,D在酸性条件下生成H进一步可推知D为苯酚钠,E为含酚羟基的苯甲酸盐,E的苯环上的一氯代物只有两种,说明两个取代基位于对位位置,可推知A的可能结构简式为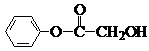 ,B的结构简式为
,B的结构简式为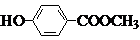 ,并以此书写有关化学方程式;化学式仍为C8H8O3,能发生银镜反应,说明含有醛基,苯环上的一氯代物仅有一种说明结构对称,苯环上的氢原子是等效的;甲醇燃料电池中,甲醇被氧化,应为电池的负极,在碱性条件下生成碳酸根离子和水,以此来书写电极反应式.
,并以此书写有关化学方程式;化学式仍为C8H8O3,能发生银镜反应,说明含有醛基,苯环上的一氯代物仅有一种说明结构对称,苯环上的氢原子是等效的;甲醇燃料电池中,甲醇被氧化,应为电池的负极,在碱性条件下生成碳酸根离子和水,以此来书写电极反应式.
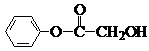 ,B的结构简式为
,B的结构简式为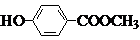 ,并以此书写有关化学方程式;化学式仍为C8H8O3,能发生银镜反应,说明含有醛基,苯环上的一氯代物仅有一种说明结构对称,苯环上的氢原子是等效的;甲醇燃料电池中,甲醇被氧化,应为电池的负极,在碱性条件下生成碳酸根离子和水,以此来书写电极反应式.
,并以此书写有关化学方程式;化学式仍为C8H8O3,能发生银镜反应,说明含有醛基,苯环上的一氯代物仅有一种说明结构对称,苯环上的氢原子是等效的;甲醇燃料电池中,甲醇被氧化,应为电池的负极,在碱性条件下生成碳酸根离子和水,以此来书写电极反应式.解答:解:(1)A在碱性条件下能发生水解,应是酯,它在碱性条件下水解生成羧酸盐和醇,根据生成的六元环状酯,说明C中既含有羧基,又含有羟基,应为HOCH2COOH,从逆向生成H的条件看,可推知H也是酯,由H、G均可发生银镜反应,所以可推知F是甲醇,G应是甲酸.再根据苯制取的原理和E与碱石灰共热生成D,D在酸性条件下生成H进一步可推知D为苯酚钠,E为含酚羟基的苯甲酸盐,E的苯环上的一氯代物只有两种,说明两个取代基位于对位位置,可推知A的可能结构简式为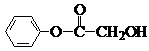 ,B的结构简式为
,B的结构简式为 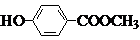 ,故答案为:
,故答案为: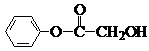
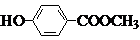 ;
;
(2)H、G均可发生银镜反应,则结构中应含有醛基,故答案为:醛基;
(3)HOCH2COOH既含有羧基,又含有羟基,在一定条件下能发生酯化反应生成环酯和水,故答案为:2HOCH2COOH
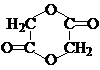 +H2O;
+H2O;
(4)苯酚能与溴水发生取代反应,当溴水足量时,生成三溴苯酚,故答案为: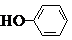 +3Br2---→
+3Br2---→ +3HBr;
+3HBr;
(5)化学式仍为C8H8O3,能发生银镜反应,且苯环上的一氯代物仅有一种,说明分子中含有醛基,并且结构对称,苯环中只有一种氢原子,则苯环中至少含有三个取代基,据此可知符合条件的同分异构体有: ;
; 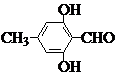 ,故答案为:
,故答案为: ;
; 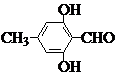 ;
;
(6)甲醇燃料电池中,甲醇被氧化,应为电池的负极,在碱性条件下生成碳酸根离子和水,发生反应为:负极:CH3OH-6e-+8OH-═CO32-+6H2O;正极:O2+4e-+2H2O═4OH-,
故答案为:CH3OH-6e-+8OH-═CO32-+6H2O.
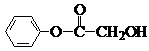 ,B的结构简式为
,B的结构简式为 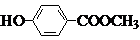 ,故答案为:
,故答案为: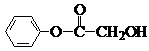
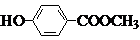 ;
;(2)H、G均可发生银镜反应,则结构中应含有醛基,故答案为:醛基;
(3)HOCH2COOH既含有羧基,又含有羟基,在一定条件下能发生酯化反应生成环酯和水,故答案为:2HOCH2COOH
| ||
| △ |
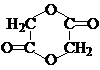 +H2O;
+H2O;(4)苯酚能与溴水发生取代反应,当溴水足量时,生成三溴苯酚,故答案为:
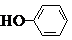 +3Br2---→
+3Br2---→ +3HBr;
+3HBr;(5)化学式仍为C8H8O3,能发生银镜反应,且苯环上的一氯代物仅有一种,说明分子中含有醛基,并且结构对称,苯环中只有一种氢原子,则苯环中至少含有三个取代基,据此可知符合条件的同分异构体有:
 ;
; 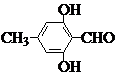 ,故答案为:
,故答案为: ;
; 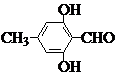 ;
;(6)甲醇燃料电池中,甲醇被氧化,应为电池的负极,在碱性条件下生成碳酸根离子和水,发生反应为:负极:CH3OH-6e-+8OH-═CO32-+6H2O;正极:O2+4e-+2H2O═4OH-,
故答案为:CH3OH-6e-+8OH-═CO32-+6H2O.
点评:本题考查有机物的合成与推断,涉及到结构简式的书写、官能团的判断、同分异构体以及电化学知识,做题注意把握题中关键信息,本题具有较强的综合性.

练习册系列答案
相关题目


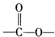 基团.
基团.