题目内容
某蓄电池放电、充电时的反应为Fe+Ni2O3+3H2O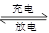 Fe(OH)2+2Ni(OH)2
Fe(OH)2+2Ni(OH)2
下列推断中正确的是( )
①放电时,Fe为正极,Ni2O3为负极 ②充电时,阴极上的电极反应式是:Fe(OH)2+2e-=Fe+2OH- ③充电时,Ni(OH)2为阳极 ④该蓄电池的电极必须是浸在某种碱性电解质溶液中
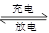 Fe(OH)2+2Ni(OH)2
Fe(OH)2+2Ni(OH)2下列推断中正确的是( )
①放电时,Fe为正极,Ni2O3为负极 ②充电时,阴极上的电极反应式是:Fe(OH)2+2e-=Fe+2OH- ③充电时,Ni(OH)2为阳极 ④该蓄电池的电极必须是浸在某种碱性电解质溶液中
| A.①②③ | B.①②④ | C.①③④ | D.②③④ |
D
根据元素化合价变化,放电时Fe为负极,Ni2O3为正极,①错;充电时,阴极发生还原反应,②对;充电时,Ni(OH)2中Ni元素的化合价升高,因此Ni(OH)2为阳极,③对;因Fe、Ni2O3、Fe(OH)2、Ni(OH)2均可以与酸反应,因此该蓄电池的电极必须浸在碱性电解质溶液中。

练习册系列答案
相关题目
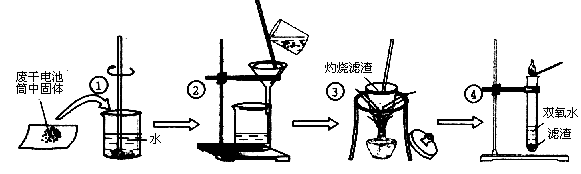
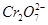 的工业废水的处理。下列说法正确的是
的工业废水的处理。下列说法正确的是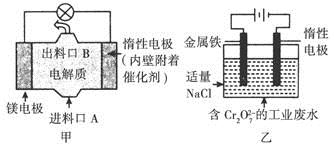
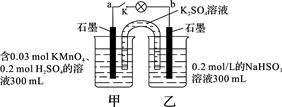
 4H2O
4H2O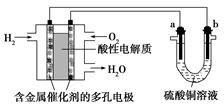
 Pb+PbO2+2H2SO4,下列叙述中,正确的是
Pb+PbO2+2H2SO4,下列叙述中,正确的是