题目内容
如图所示,装置在常温下工作(溶液体积变化忽略不计)。闭合K,灯泡发光。下列叙述中不正确的是
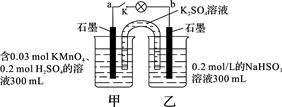

| A.当电路中有1.204×1022个电子转移时,乙烧杯中溶液的pH约为1 |
| B.电池工作时,盐桥中的K+移向甲烧杯,外电路的电子方向是从b到a |
| C.电池工作时,甲烧杯中由水电离出的c(H+)逐渐减小 |
| D.乙池中的氧化产物为SO42- |
C
试题分析:A.n(e-)=1.204×1022÷6.02×1023=0.02mol.则在乙烧杯中发生反应的NaHSO3的物质的量为0.01mol。产生的H+的物质的量为0.01mol。c(H+)=0.01mol÷0.1L=0.1mol/L。溶液中的H+主要是由NaHSO3反应产生。所以pH=1正确。B.在该原电池反应中,乙池的石墨电极为负极,甲池的石墨电极为正极。根据同种电荷相互排斥,异种电荷相互吸引的原则,电池工作时,盐桥中的K+移向甲烧杯,外电路的电子方向是从b到a。正确。C.电池工作时,甲烧杯中MnO4-不断得到电子,变为Mn2+,消耗H+,溶液中的c(H+)不断减小,所以由水电离出的c(H+)逐渐增大。错误。D.在乙池中HSO3-不断被氧化,变为SO42-。因此该烧杯的氧化产物为SO42-。

练习册系列答案
相关题目
 2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是
2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是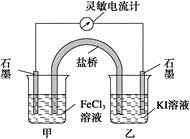
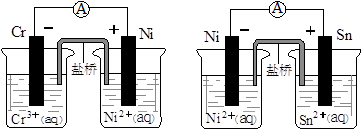
 Fe(OH)2+2Ni(OH)2
Fe(OH)2+2Ni(OH)2 2H2O,负极反应为:H2+C-2e-
2H2O,负极反应为:H2+C-2e- Zn2++Mn2O3(s)+2NH3↑+H2O,在此电池放电时正极(碳棒)上发生反应的物质是( )
Zn2++Mn2O3(s)+2NH3↑+H2O,在此电池放电时正极(碳棒)上发生反应的物质是( )