题目内容
电化学在日常生活中用途广泛,图甲是镁—次氯酸钠燃料电池,电池总反应为Mg+ClO-+H2O=Cl-+Mg(OH)2↓,图乙是含
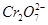 的工业废水的处理。下列说法正确的是
的工业废水的处理。下列说法正确的是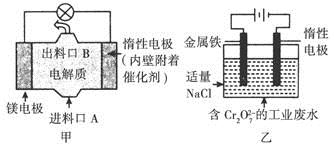
A.图乙中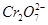 向惰性电极移动,与该极近的OH-结合转化成Cr(OH)3除去 向惰性电极移动,与该极近的OH-结合转化成Cr(OH)3除去 |
| B.图乙的电解池中,有0.084 g阳极材料参与反应,阴极会有336 mL的气体产生 |
| C.图甲中发生的还原反应是Mg2++ClO-+H2O+2e-=Cl-+Mg(OH)2↓ |
| D.若图甲中3.6 g镁溶液产生的电量用以图乙废水处理,理论可产生10.7 g氢氧化铁沉淀 |
C
A项,在电解池中,阴离子应该移向阳极,根据装置乙可知,惰性电极做阴极;B项,未标明标准状况,故无法计算产生气体的体积;C项,根据装置甲可知,镁做负极,发生电极反应是Mg-2e-=Mg2+;D项,图甲中溶解3.6 g镁时,失去的电子是0.3 mol,在图乙中阳极反应是Fe-2e-=Fe2+,根据电子守恒可得此时生成的Fe2+是0.15 mol,所以最后生成的氢氧化铁也是0.15 mol即16.05 g。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目

 2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是
2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是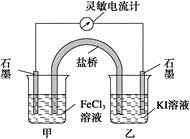
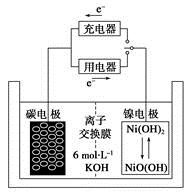
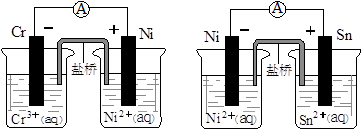
 Fe(OH)2+2Ni(OH)2
Fe(OH)2+2Ni(OH)2 Zn2++Mn2O3(s)+2NH3↑+H2O,在此电池放电时正极(碳棒)上发生反应的物质是( )
Zn2++Mn2O3(s)+2NH3↑+H2O,在此电池放电时正极(碳棒)上发生反应的物质是( )