题目内容
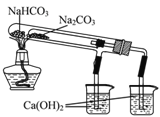
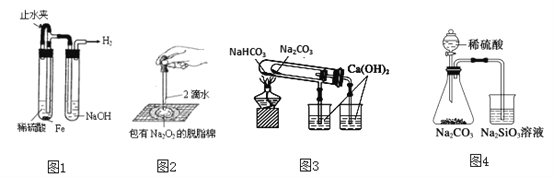
【题目】I.某火力发电厂以煤为燃料,排出的废气中含有CO2、SO2、水蒸气。为检验该废气中的成分,用如图所示的装置进行实验:

(1)仪器连接的顺序为(填导管接口字母) ;
(2)根据 现象证明有CO2;
(3)装置B的作用是 ,装置D的作用是 。
II. 为探究SO2的漂白是SO2直接作用于有色物质,还是SO2与水反应的产物的作用,设计如图装置进行实验:(图中所用硫酸的质量分数为70%)

(4)亚硫酸钠与浓硫酸反应的化学方程式: ;
(5)为探究干燥的SO2 能不能使品红褪色,请指出设计的实验装置图中两个明显的不足:
① ,
② ;
(6)按照修改后的装置,实验中控制SO2以大约每秒3个气泡的速度通过品红的酒精溶液时,经过一小时后,品红仍不褪色。这说明品红褪色的原因不是SO2直接导致。所以,SO2 通过品红水溶液后,引起品红褪色的微粒可能是 。
【答案】(1)e-f-c-d-b
(2)D中品红溶液不褪色,A中澄清石灰水变混浊
(3)检验是否含SO2检验SO2是否被完全吸收
(4)Na2SO3+H2SO4==Na2SO4+H2O+SO2↑
(5)①SO2未干燥②没有进行尾气处理
(6)H2SO3.HSO3-或SO32-(任填其中一个)
【解析】
试题分析:(1)由于A、B、C、D中的水蒸气可能随气流进入E中会影响对废气中水蒸气的检验,因此应把装置E放在整套装置的最前端,首先检验废气中是否含有水蒸气;由于二氧化硫也能使澄清石灰水变浑浊,因此在使用澄清石灰水检验二氧化碳前应把废气中可能含有二氧化硫检验并全部除去;这样分析下来,最后利用澄清石灰水检验废气中的二氧化碳即可完成整个检验任务;在连接装置时,还需要注意进气管与出气管的选择,进气管一定要伸入溶液中;因此连接顺序为e→f→c→d→b(e、f可互换);(2)CO2和SO2都能使澄清石灰水变浑浊,而只有SO2能使品红褪色,检验CO2之前,要先检验SO2是否除去,所以根据D中品红溶液不褪色,A中澄清石灰水变混浊来证明CO2的存在。
(3)废气通入装置B时,含有的二氧化硫气体能使品红溶液褪色,因此观察到此处品红溶液褪色时即可说明废气中含有二氧化硫;装置D的品红溶液如果不褪色,说明废气中的二氧化硫已完全被装置C中高锰酸钾溶液吸收,则不会影响后面对二氧化碳的检验;
(4)亚硫酸钠和浓硫酸反应生成硫酸钠、SO2和水,反应的化学方程式为Na2SO3+H2SO4=Na2SO4+H2O+SO2↑。
(5)该实验的目的是探究干燥的SO2 能不能使品红褪色,且SO2有毒,不能排放到空气中,所以根据装置图,明显的不足是①SO2未干燥;②没有进行尾气处理。
(6)二氧化硫与水反应的溶液中含有SO32-、HSO3-、H2SO3,那么二氧化硫能使品红的水溶液褪色的粒子可能是三种中的一种或几种。

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案【题目】下列根据实验操作和现象所得出的结论正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向Na2SiO3溶液中通入适量CO2气体 | 出现白色沉淀 | H2CO3的酸性比H2SiO3强 |
B | 向无色溶液中加硝酸酸化的BaCl2溶液 | 有白色沉淀 | 原溶液中一定含SO |
C | 将气体X通入品红溶液中 | 红色褪去 | X一定是SO2 |
D | 向某溶液中先加氯水再加KSCN溶液 | 溶液呈血红色 | 原溶液中一定含Fe2+ |
A. A B. B C. C D. D
【题目】化学反应原理在化工生产和实验中有着广泛而重要的应用。
Ⅰ.利用含锰废水(主要含Mn2+、SO![]() 、H+、Fe2+、Al3+、Cu2+)可制备高性能磁性材料碳酸锰(MnCO3)。其中一种工艺流程如下:
、H+、Fe2+、Al3+、Cu2+)可制备高性能磁性材料碳酸锰(MnCO3)。其中一种工艺流程如下:

已知某些物质完全沉淀的pH如下表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 | Mn(OH)2 | CuS | MnS | MnCO3 |
沉淀完全时的pH | 3.2 | 5.4 | 6.4 | 9.8 | ≥0 | ≥7 | ≥7 |
回答下列问题:
(1)过程②中,所得滤渣W的主要成分是______________________。
(2)过程③中,发生反应的离子方程式是______________________。
(3)过程④中,若生成的气体J可使澄清石灰水变浑浊,则生成MnCO3的反应的离子方程式是_______________________。
(4)由MnCO3可制得重要的催化剂MnO2:2MnCO3+O2===2MnO2+2CO2。现在空气中加热460.0 g MnCO3,得到332.0 g产品,若产品中杂质只有MnO,则该产品中MnO2的质量分数是________(用百分数表示,小数点后保留1位小数)。
Ⅱ.常温下,浓度均为0.1 mol·L-1的下列六种溶液的pH如下表:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN/span> | C6H5ONa |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
(1)上述盐溶液中的阴离子,结合H+能力最强的是_______________________。
(2)根据表中数据判断,浓度均为0.01 mol·L-1的下列物质的溶液中,酸性最强的是________(填序号)。
A. HCN B. HClO C. C6H5OH D. CH3COOH E. H2CO3
Ⅲ.已知:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH = Q kJ·mol-1其平衡常数随温度变化如下表所示:
CO2(g)+H2(g) ΔH = Q kJ·mol-1其平衡常数随温度变化如下表所示:
温度/℃ | 400 | 500 | 850 |
平衡常数 | 9.94 | 9 | 1 |
请回答下列问题:
(1)上述反应的化学平衡常数表达式为___,该反应的Q____(填“>”或“<”)0。
(2)850 ℃时,向体积为10 L的反应器中通入一定量的CO和H2O(g),发生上述反应,CO和H2O(g)的浓度变化如图所示,则0~4 min时平均反应速率v(CO)=____。
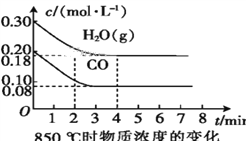
(3)若在500 ℃时进行上述反应,且CO、H2O(g)的起始浓度均为0.020 mol·L-1,该条件下,CO的最大转化率为____。
(4)若在850 ℃时进行上述反应,设起始时CO和H2O(g)共为1 mol,其中水蒸气的体积分数为x,平衡时CO的转化率为y,试推导y随x变化的关系式:____。