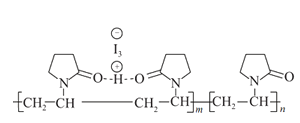
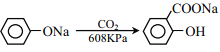
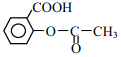题目内容
【题目】下列有关热化学方程式的叙述中,不正确的是
A.含20.0g NaOH的稀溶液与稀盐酸完全中和放出28.7 kJ的热量,则表示该反应中和热的热化学方程式为NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1) H=-57.4kJmol-1
B.根据C(石量,s)=C(金刚石,s) H>0 可知石墨比金刚石稳定
C.根据2H2(g)+O2(g)=2H2O(l) H=-483.6 kJmol-l可知H2的燃烧热为241.8kJmol-1
D.由C(s)+O2(g)=CO2(g) H1,C(s)+![]() O2(g)=CO(g) H2 可知 H1>H2
O2(g)=CO(g) H2 可知 H1>H2
【答案】D
【解析】
A.依据酸碱中和热概念是强酸强碱在稀溶液反应生成1mol水放出的热量计算分析,20.0g NaOH的物质的量是0.5mol,含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则1molNaOH即40gNaOH完全反应放热57.4 kJ,所以表示中和热的热化学方程式为:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1) H=-57.4kJmol-1,A正确;
B.根据C(石墨,s)=C(金刚石,s)△H>0,可知石墨的能量低于金刚石的能量,物质具有的能量越低越稳定,所以石墨比金刚石稳定,B正确;
C.氢气的燃烧热是lmol氢气完全燃烧生成稳定氧化物液态水放出的热量,由题目已知的热化学方程式可知H2的燃烧热为241.8kJmol-1,C正确;
D.物质C燃烧反应是放热反应,完全燃烧放出的能量比不完全燃烧放出的能量多,但是反应是放热的,焓变是带有负号的,反应放出的热量越多,反应热就越小,所以△H1<△H2,D错误;
故合理选项是D。

 举一反三期末百分冲刺卷系列答案
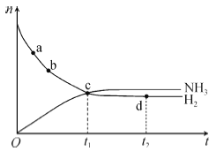
举一反三期末百分冲刺卷系列答案【题目】在100℃时,将0.40 mol二氧化氮气体充入一个2 L抽空的密闭容器中,发生反应:2NO2 N2O4。每隔一段时间就对该容器内的物质进行分析,得到下表数据:
时间/s | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
(1)在上述条件下,从反应开始至20 s时,用NO2表示的平均反应速率为__________mol·L1·s1。
(2)n3________(填“>”“<”或“=”)n4;该反应的平衡常数K的数值为___________(精确到0.1)。
(3)若在相同条件下最初向该容器中充入N2O4,要达到上述平衡状态,N2O4的起始浓度是______mol·L1。
(4)上述(3)达到平衡后N2O4的转化率为______________,混合气体的平均摩尔质量为______________。
(5)达到平衡后,如果升高温度,气体颜色会变深,则升高温度后,反应2NO2N2O4的平衡常数将_______________(填“增大”“减小”或“不变”)。
(6)达到平衡后,如果向该密闭容器中再充入0.32 mol He,并把容器体积扩大为4 L,则平衡将______________(填“向左移动”“向右移动”或“不移动”)。
【题目】根据要求完成下列各小题:
Ⅰ.(1)理论上稀的强酸、强碱反应生成1mol H2O(l)时放出57.3kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式________ 。
(2)已知:乙苯催化脱氢制苯乙烯反应:苯在计算键能时,此处可看作为![]() ,
, ![]()
![]()
![]() +H2(g)
+H2(g)
化学键 | C—H | C—C | C=C | H—H |
键能/kJ·mol-1 | 412 | 348 | 612 | 436 |
计算上述反应的ΔH=________ kJ·mol-1。
Ⅱ.25 ℃时,部分物质的电离平衡常数如表所示,请回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为_______。
(2)将少量CO2气体通入NaClO溶液中,写出反应的离子方程式:________。