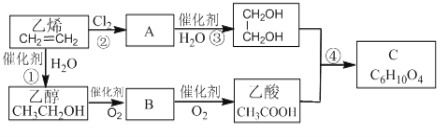
题目内容
【题目】设NA为阿伏加德罗常数的值,下列叙述中不正确的是
A. 25℃,pH=13的Ba(OH)2溶液中OH-数目为0.1NA
B. 常温常压下,22.4L Cl2和5.6gFe充分反应转移电子数目为0.3 NA
C. 8.0gCu2S和CuO的混合物中所含的铜原子数为0.1 NA
D. 标准状况下,5.6L乙烷中含有的极性键数目为1.5NA
【答案】A
【解析】
A. 溶液的体积未知,无法计算溶液中OH-数目;
B. 铁与氯气充分反应生成氯化铁,反应物中有22.4L Cl2和5.6gFe,分别换算成物质的量
可知,铁少量,据此分析作答;
C. 混合物中Cu2S的摩尔质量是CuO的两倍,其分子内所含铜原子数也为CuO的两倍,据此分析作答;
D. 1 mol乙烷分子中所含极性键6 mol;
A. 因溶液的体积未知,条件不足则无法通过溶液中的pH值换算成OH-数目,故A项错误;
B. 铁与氯气反应的方程式为:3Cl2+2Fe![]() 2FeCl3,常温常压下22.4L Cl2的物质的量略小于1 mol,而5.6 g Fe的物质的量为
2FeCl3,常温常压下22.4L Cl2的物质的量略小于1 mol,而5.6 g Fe的物质的量为![]() = 0.1 mol,根据化学方程式的计量数可看出,充分反应,氯气剩余,依据关系式2Fe
= 0.1 mol,根据化学方程式的计量数可看出,充分反应,氯气剩余,依据关系式2Fe![]() 6e-得,5.6gFe充分反应转移电子数目为0.3 NA,故B项正确;
6e-得,5.6gFe充分反应转移电子数目为0.3 NA,故B项正确;
C. 混合物中Cu2S的摩尔质量是CuO的两倍,其分子内所含铜原子数也为CuO的两倍,则 8.0 g Cu2S和CuO的混合物可以等效成是CuO,则其含有的铜原子数为![]() ×NA = 0.1 NA,故C项正确;
×NA = 0.1 NA,故C项正确;
D. 标准状况下,5.6 L乙烷的物质的量为![]() = 0.25 mol,乙烷分子的结构简式为
= 0.25 mol,乙烷分子的结构简式为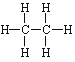 ,则0.25 mol乙烷分子中所含极性键6 ×0.25 mol×NA = 1.5NA,故D项正确;
,则0.25 mol乙烷分子中所含极性键6 ×0.25 mol×NA = 1.5NA,故D项正确;
答案选A。

【题目】近年来,雾霾天气多次肆虐全国各地。其中,燃煤的烟道气和汽车尾气中含有的氮氧化合物是造成空气污染的原因之一。
(1)用CH4催化还原氮氧化物。已知CH4 (g)+2O2 (g)=CO2 (g)+2H2O (l);ΔH1=a kJ/mol,欲计算反应CH4 (g)+4NO (g)=2N2 (g)+CO2 (g)+2H2O (l)的焓变ΔH2 , 则还需要查找某化合反应的焓变ΔH3,当反应中各物质化学计量数之比为最简整数比时 ΔH3 = b kJ/mol,则该反应的热化学方程式为____________________。据此计算出ΔH2 =_______kJ/mol(用含a和b的式子表示)。
(2)用活性炭还原法处理氮氧化物。有关反应为:C(s) + 2NO(g)![]() N2 (g) + CO2 (g) ΔH。某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2 (g) + CO2 (g) ΔH。某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
浓度/mol·L-1 时间/min | NO | N2 | CO2 |
0 | 0.100 | 0 | 0 |
10 | 0.058 | 0.021 | 0.021 |
20 | 0.040 | 0.030 | 0.030 |
30 | 0.040 | 0.030 | 0.030 |
40 | 0.032 | 0.034 | 0.017 |
50 | 0.032 | 0.034 | 0.017 |
① T1℃时,该反应的平衡常数K=___________(保留两位小数)。
② 30 min后,改变某一条件,反应重新达到平衡,则改变的条件可能是________________。
③ 若30 min后升高温度至T2℃/span>,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则该反应的ΔH____________0(填“>”、“=”或“<”)。
【题目】室温下,某一元弱酸HA的电离常数K=1.6×10-6。 向20.00 mL 浓度约为0.1 mol·L-1 HA溶液中逐滴加入0.1000 mol·L-1 的标准NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。请回答下列有关问题:(已知lg4=0.6)
(1)a点溶液中pH约为________,此时溶液中H2O电离出的c(H+)为________。

(2)a、b、c、d四点中水的电离程度最大的是________点,滴定过程中宜选用__________作指示剂,滴定终点在________(填“c点以上”或“c点以下”)。
(3)滴定过程中部分操作如下,下列各操作使测量结果偏高的是_________________(填字母序号)。
A.滴定前碱式滴定管未用标准NaOH溶液润洗
B.用蒸馏水洗净锥形瓶后,立即装入HA溶液后进行滴定
C.滴定过程中,溶液出现变色后,立即停止滴定
D.滴定结束后,仰视液面,读取NaOH溶液体积
(4)若重复三次滴定实验的数据如下表所示,计算滴定所测HA溶液的物质的量浓度为_____mol/L。
实验序号 | NaOH溶液体积/mL | 待测HA溶液体积/mL |
1 | 21.01 | 20.00 |
2 | 20.99 | 20.00 |
3 | 21.60 | 20.00 |
【题目】某化学反应2A![]() B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
实验 | 时 间 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 800℃ | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为 mol/(L·min)。
(2)在实验2,A的初始浓度c2=____________mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是___________。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3_______v1(填>、=、<),且c3_______1.0 mol/L(填>、=、<)。
(4)比较实验4和实验1,可推测该反应是________反应(选填吸热、放热)。理由是