题目内容
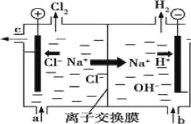
【题目】氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。完成下列填空:
(1)写出电解饱和食盐水的离子方程式 。
(2)离子交换膜的作用为 : 、 。
(3)精制饱和食盐水从图 中________位置补充,氢氧化钠溶液从图中 位置流出。(选填“a”、“b”、“c”或“d”)
(4)KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。写出该反应的化学方程式 。
(5)室温下,0.1mol/LNaClO溶液的pH 0.1 mol/LNa2SO3溶液的pH。(选填“大于”、“小于”或“等于”)
(6)浓度均为0.1mol/L的Na2SO3和Na2CO3的混合溶液中,SO32-、CO32-、HSO3-、HCO3-浓度从大到小的顺序为 。
【答案】(1)2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑;(2)得到纯度较高的氢氧化钠溶液;避免氢气和氯气反应;(3)a,d;(4)2KClO3+2H2SO4+H2C2O4=2ClO2↑+2CO2↑+2KHSO4+2H2O;(5)大于;(6)c(SO32-)>c(CO32-)>c(HCO3-)>c(HSO3-)。
2OH-+H2↑+Cl2↑;(2)得到纯度较高的氢氧化钠溶液;避免氢气和氯气反应;(3)a,d;(4)2KClO3+2H2SO4+H2C2O4=2ClO2↑+2CO2↑+2KHSO4+2H2O;(5)大于;(6)c(SO32-)>c(CO32-)>c(HCO3-)>c(HSO3-)。
【解析】
试题分析:(1)电解饱和食盐水得到氢气、氯气、氢氧化钠,其离子反应方程式为:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑;(2)因为氯气和氢氧化钠反应,氢气和氯气反应,因此交换膜的作用是:得到纯度较高的氢氧化钠溶液;避免氢气和氯气反应;(3)根据装置图,阳极区消耗Cl-,因此从a处补充NaCl溶液;阴极区产生NaOH,因此从d处流出氢氧化钠溶液;(4)KClO3做氧化剂,Cl由+5价→+4价,H2C2O4中C由+3价→+4价,根据化合价升降法进行配平,2KClO3+2H2SO4+H2C2O4=2ClO2↑+2CO2↑+2KHSO4+2H2O;(5)亚硫酸的酸性强于碳酸,碳酸的酸性强于次氯酸,亚硫酸的酸性强于次氯酸,根据盐类水解的规律,越弱越水解,ClO-水解程度大于SO32-,NaClO的pH大于Na2SO3;(6)碳酸的酸性弱于亚硫酸,CO32-的水解程度大于SO32-,但水解程度微弱,因此离子浓度大小顺序是c(SO32-)>c(CO32-)>c(HCO3-)>c(HSO3-)。
2OH-+H2↑+Cl2↑;(2)因为氯气和氢氧化钠反应,氢气和氯气反应,因此交换膜的作用是:得到纯度较高的氢氧化钠溶液;避免氢气和氯气反应;(3)根据装置图,阳极区消耗Cl-,因此从a处补充NaCl溶液;阴极区产生NaOH,因此从d处流出氢氧化钠溶液;(4)KClO3做氧化剂,Cl由+5价→+4价,H2C2O4中C由+3价→+4价,根据化合价升降法进行配平,2KClO3+2H2SO4+H2C2O4=2ClO2↑+2CO2↑+2KHSO4+2H2O;(5)亚硫酸的酸性强于碳酸,碳酸的酸性强于次氯酸,亚硫酸的酸性强于次氯酸,根据盐类水解的规律,越弱越水解,ClO-水解程度大于SO32-,NaClO的pH大于Na2SO3;(6)碳酸的酸性弱于亚硫酸,CO32-的水解程度大于SO32-,但水解程度微弱,因此离子浓度大小顺序是c(SO32-)>c(CO32-)>c(HCO3-)>c(HSO3-)。

【题目】除去下列物质中的杂质,所用试剂和方法不正确的是( )
物质 | 杂质 | 除杂所用试剂和方法 | |
A | KCl溶液 | I2 | 酒精,萃取 |
B | KNO3 | K2SO4 | Ba(NO3)2溶液,过滤 |
C | Cu | CuO | 盐酸,过滤 |
D | CaCO3 | CaO | H2O,过滤 |
【题目】下列有关实验的操作正确的是
选项 | 实验目的 | 实验操作 |
A | 检验钾离子 | 铂丝蘸取试样在火焰上灼烧,直接观察火焰颜色 |
B | 除去FeCl2溶液中混有的FeCl3 | 加入足量铁粉,搅拌、静置、过滤 |
C | 制备Fe(OH)3胶体 | 饱和FeCl3溶液滴入热的NaOH溶液中 |
D | 用苯萃取溴水中的溴 | 先从分液漏斗下口放出水层,再放出有机层 |

