题目内容
【题目】化学电池的研究一直是化学工作者研究的热点之一.
Ⅰ.美国科学家S鲁宾成功开发锌汞纽扣式电池,以锌和氧化汞为电极材料,氢氧化钾溶液为电解液的原电池,有效地解决电池使用寿命短,易发生漏液等问题.电池总反应为:Zn+HgO═ZnO+Hg。
(1)该电池的正极反应式为 。
(2)含汞电池生产企业的污水中会含有一定量的+2价的汞离子,通常采用处理成本较低的硫化物沉淀法,即向污水中投入一定量的硫化钠,反应的离子方程式为 。
(3)该方法的缺点是产物的颗粒比较小,大部分悬浮于污水中,通常采用投入一定量的明矾晶体进行后续处理,请解释其原因 。
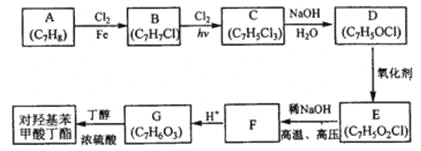
Ⅱ.锂离子电池由于轻便、比能量大等优点,成为当今社会最为常见的电池.其中的重要材料磷酸亚铁锂(LiFePO4)通常按照下列流程进行生产:

请回答下列问题:
(4)生产过程中“混合搅拌”的目的是 。气体X的化学式为 。
(5)请写出一定条件下由LiH2PO4生成LiFePO4的化学方程式 ,当生成1mol磷酸亚铁锂时,转移的电子数目为 。
(6)生成LiFePO4的过程可能产生一种杂质对电池有致命的影响,则该杂质可能为 。
【答案】I.(1)HgO+H2O+2e﹣=Hg+2OH﹣;
(2)Hg2++S2﹣=HgS↓;
(3)铝离子水解得到氢氧化铝胶体具有吸附性,吸附HgS颗粒,加快HgS微粒的沉降;
Ⅱ.
(4)使反应物充分混合,提高反应速率;NH3;
(5)2LiH2PO4+Fe2O3+C=2LiFePO4+CO↑+2H2O;6.02×1023;
(6)Fe
【解析】
试题分析:I.(1)正极发生还原反应,HgO获得电子生成Hg,碱性条件下还生成氢氧根离子,该电池的正极反应式为:HgO+H2O+2e﹣=Hg+2OH﹣;
(2)硫离子与汞离子反应生成HgS沉淀,反应离子方程式为:Hg2++S2﹣=HgS↓;
(3)铝离子水解得到氢氧化铝胶体具有吸附性,吸附HgS颗粒,加快HgS微粒的沉降;
Ⅱ.(4)生产过程中“混合搅拌”的目的是:使反应物充分混合,提高反应速率,铵根离子与氢氧根离子反应生成氨气,即X为NH3;
(5)流程图中LiH2PO4与Fe2O3、C反应生成LiFePO4,Fe元素被还原,C元素被氧化生成CO,还有水生成,反应方程式为:2LiH2PO4+Fe2O3+C=2LiFePO4+CO↑+2H2O,当生成1mol磷酸亚铁锂时,转移的电子为1mol,即转移电子数目为6.02×1023;
(6)碳可能将氧化铁中Fe元素还原为Fe单质,对电池有致命的影响。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案