题目内容
将4.9克Mg和Fe的混合物在一定量的稀HNO3溶液中完全溶解(溶液中有Fe2+),得到标况下气体2.24L(假设全为NO气体),则向反应后的溶液中加入足量的烧碱,在空气中不断搅拌,充分反应后,则生成沉淀的质量是 ( )
| A.6g | B.8g | C.10g | D.10.2g |
D
最后沉淀质量=OH-质量+金属质量。由题意可知,金属虽说全溶解,但铁还没有全被氧化成三价铁,加足量的NaOH在空气中不断搅拌,Fe(OH)2将全部被氧化,所以生成的沉淀一定为Mg(OH)2、Fe(OH)3 ,不可能有Fe(OH)2 .在此还要注意的是,整个过程中既有硝酸得电子又有氧气得电子。硝酸得的电子有关系式NO3?~NO~3e-为0.3mol,如再加上空气中氧气得的电子,那么整个过程中得电子数肯定大于0.3 mol,为此金属失去的电子数也大于0.3mol.由于金属阳离子电荷总数等于金属离子结合的OH-数.由 e-~OH-可得金属离子结合的OH-也大于0.3mol.则最后沉淀大于4.9+0.3×17=10g,即生成沉淀大于10g ,选择题中至少必须有一个选项符合要求,本题正确答案只能选D

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
 +Zn+OH-+H2O
+Zn+OH-+H2O NH3+Zn(OH)
NH3+Zn(OH) 配平后,离子方程式中H2O的系数是
配平后,离子方程式中H2O的系数是 CO2(g)+H2(g) ΔH<0,CO和H2O浓度变化如图所示:
CO2(g)+H2(g) ΔH<0,CO和H2O浓度变化如图所示:
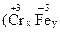 ·
·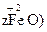 。若处理含1 mol Cr2O72-的废水至少需要加入10mol FeSO4·7H2O,则
。若处理含1 mol Cr2O72-的废水至少需要加入10mol FeSO4·7H2O,则