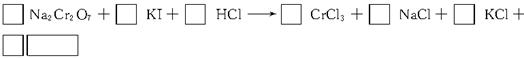
题目内容
一定条件下用甲烷可以消除氮氧化物(NOx)的污染。已知:
① CH4 ( g )+4NO2( g )=4NO( g ) +CO2( g )+2H2O( g ) △H=一574 kJ·mol-1
② CH4 ( g )+4NO( g )=2N2( g )+CO2( g )+2H2O( g ) △H=一1 160 kJ·mol一1。
下列正确的选项是
① CH4 ( g )+4NO2( g )=4NO( g ) +CO2( g )+2H2O( g ) △H=一574 kJ·mol-1
② CH4 ( g )+4NO( g )=2N2( g )+CO2( g )+2H2O( g ) △H=一1 160 kJ·mol一1。
下列正确的选项是
| A.CH4 ( g )+2NO2 ( g )= N2( g )+CO2 ( g )+2H2O ( l)△H=一867 kJ·mol-1 |
| B.CH4催化还原NOx为N2的过程中,若x=1.6,则转移的电子总数为3.2 mol |
| C.若0.2 mol CH4还原NO2至N2,在上述条件下放出的热量为173.4 kJ |
| D.若用标准状况下4.48L CH4还原NO2至N2,整个过程中转移的电子总数为3.2 mol |
C
① CH4 ( g )+4NO2( g )=4NO( g ) +CO2( g )+2H2O( g ) △H=一574 kJ·mol-1
② CH4 ( g )+4NO( g )=2N2( g )+CO2( g )+2H2O( g ) △H=一1 160 kJ·mol一1。
( ①+②)/2, 得CH4 ( g )+2NO2 ( g )= N2( g )+CO2 ( g )+2H2O (g) △H=一867 kJ·mol-1
1mol 2mol 867 kJ 8e-
0.2 mol 867×0.2 16×0.2
至于B选项,转移电子的多少与甲烷或者NOx的物质的量有关,而题目并没有涉及,且转移电子数的单位不应是mol。
② CH4 ( g )+4NO( g )=2N2( g )+CO2( g )+2H2O( g ) △H=一1 160 kJ·mol一1。
( ①+②)/2, 得CH4 ( g )+2NO2 ( g )= N2( g )+CO2 ( g )+2H2O (g) △H=一867 kJ·mol-1
1mol 2mol 867 kJ 8e-
0.2 mol 867×0.2 16×0.2
至于B选项,转移电子的多少与甲烷或者NOx的物质的量有关,而题目并没有涉及,且转移电子数的单位不应是mol。

练习册系列答案
 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目