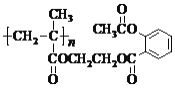题目内容
【题目】某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。为此,他们设计了如下装置验证所产生的气体。
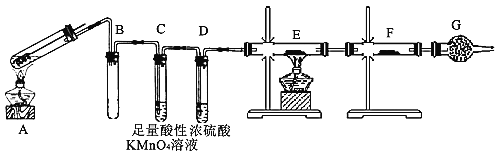
(1)B的作用是_____________,G的作用是____________;请写出C中发生的离子反应方程式_________。
(2)填写装置中可能使用的药品:E_________,F________。
(3)证明有H2生成的实验现象是__________。
(4)若判断出有H2生成,取少量A中反应后的溶液,加入KSCN溶液,溶液_____(填“是”或“否”)变红色。
【答案】防止倒吸 防止空气中的H2O进入F 5SO2+2MnO4-+2H2O=2Mn2++4H++5SO42- CuO 无水CuSO4 E中黑色(CuO)变成红色(Cu),F中白色粉末变成蓝色 是
【解析】
由图可知,A中发生Fe与浓硫酸的反应生成SO2还可能生成氢气,B中均为短导管可防止倒吸,C中高锰酸钾褪色可检验SO2,D干燥气体,E中装氧化铜,检验氢气,其发生的化学反应方程式为:CuO+H2![]() Cu+H2O,F中装无水硫酸铜,可检验E中的氧化产物H2O,G为干燥管,G可防止空气中的水进入F中干扰E中氧化产物的检验。
Cu+H2O,F中装无水硫酸铜,可检验E中的氧化产物H2O,G为干燥管,G可防止空气中的水进入F中干扰E中氧化产物的检验。
(1)熄灭A装置中酒精灯时,A装置中气体冷却压强减小,C装置中溶液易进入A试管中产生倒吸现象,所以B装置的作用是防止倒吸,C中高锰酸钾褪色可检验SO2,空气中含有水蒸气,如果没有G装置,水蒸气进入F装置干扰实验,所以G的作用是防止空气中的
H2O进入F,酸性高锰酸钾溶液有强氧化性,二氧化硫能与酸性高锰酸钾溶液发生氧化还原反应而使其褪色,其化学反应方程式为:
5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4,其离子反应方程式为:5SO2+2MnO4-+2H2O=2Mn2++4H++5SO42-,故答案为:防止倒吸;防止空气中的H2O进入F;5SO2+2MnO4-+2H2O=2Mn2++4H++5SO42-;
(2)生成的气体经洗气和干燥后剩余的气体就是氢气,氢气有还原性能和氧化铜在加热条件下发生置换反应生成铜单质,生成的水遇无水硫酸铜时白色固体变蓝色,所以E中装CuO,F中装无水CuSO4,故答案为:CuO;无水CuSO4;
(3)证明含有氢气的现象是:E中黑色(CuO)变成红色(Cu),F中白色粉末变成蓝色,故答案为:E中黑色(CuO)变成红色(Cu),F中白色粉末变成蓝色;
(4)若判断出有H2生成,说明A中既有Fe3+,也有Fe2+,取少量A中反应后的溶液,加入KSCN溶液,溶液会变红色,故答案为:是。

 互动英语系列答案
互动英语系列答案【题目】下列实验中所用的试剂、仪器或用品![]() 夹持装置、活塞、导管省去
夹持装置、活塞、导管省去![]() 能够达到该目的的是
能够达到该目的的是
选项 | 目的 | 试剂 | 仪器或用品 |
A | 验证牺牲阳极的阴极保护法 | 酸化的NaCl溶液、Zn电极、Fe电极、铁氰化钾 | 烧杯、电流表、导线、胶头滴管 |
B | 铝热反应 | 氧化铁、铝粉 | 滤纸、酒精灯、木条、盛沙子的蒸发皿 |
C | 除乙烷中混有的乙烯 | 酸性高锰酸钾溶液 | 气囊、集气瓶、水槽 |
D | 制备乙酸乙酯 | 乙醇、乙酸、饱和碳酸钠溶液 | 大小试管、酒精灯 |
A.AB.BC.CD.D
【题目】对下表中实验操作或现象的解释不合理的是![]()
实验操作及现象 | 现象的解释 | |
A | 将一片铝箔置于酒精灯外焰上灼烧,铝箔熔化但不滴落 | 单质铝的熔点特别高 |
B | 用玻璃尖嘴导管导出氢气,点燃,观察到火焰呈黄色 | 普通玻璃中含有钠元素 |
C | 往水中加入 | 产生了碱性物质,且 |
D | 向过量的苯酚浓溶液中滴加少许饱和溴水,振荡,未观察到白色沉淀产生 | 三溴苯酚溶解在过量的苯酚中 |
A.AB.BC.CD.D