题目内容
室温时,将pH=12的NaOH溶液与pH=2的CH3COOH溶液等体积混合后,下列关系式中正确的是( )
| A、c(Na+)>c (CH3COO-)>c(OH-)>c(H+) |
| B、c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| C、c(Na+)=c(CH3COO-)+c(CH3COOH) |
| D、c(H+)=c(CH3COO-)+c(OH-) |
考点:酸碱混合时的定性判断及有关ph的计算,离子浓度大小的比较
专题:电离平衡与溶液的pH专题
分析:CH3COOH为弱酸,在25℃时将pH=12的NaOH溶液中氢氧化钠浓度为0.01mol/L,而pH=2的CH3COOH溶液中醋酸的浓度大于0.01mol/L,两溶液等体积混合时,醋酸过量,溶液呈酸性,则有c(CH3COO-)>c(Na+)>c(H+)>c(OH-);
设溶液体积为1L,则n(Na+)=0.01mol,n(CH3COO-)+n(CH3COOH)>0.01mol,所以c(Na+)<c(CH3COO-)+c(CH3COOH);
溶液中一定满足电荷守恒:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),
根据以上分析进行判断.
设溶液体积为1L,则n(Na+)=0.01mol,n(CH3COO-)+n(CH3COOH)>0.01mol,所以c(Na+)<c(CH3COO-)+c(CH3COOH);
溶液中一定满足电荷守恒:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),
根据以上分析进行判断.
解答:
解:A.在25℃时将pH=12的NaOH溶液与pH=2的CH3COOH溶液等体积混合时,醋酸过量,溶液显示酸性,c(H+)>c(OH-),根据电荷守恒可知c(CH3COO-)>c(Na+),故A错误;
B.在25℃时将pH=12的NaOH溶液与pH=2的CH3COOH溶液等体积混合时,醋酸过量,溶液呈酸性,则有c(CH3COO-)>c(Na+),c(H+)>c(OH-),由于H+离子与OH-离子反应,则溶液中c(Na+)>c(H+),所以溶液中离子浓度大小为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故B正确;
C.设溶液的体积都为1L,CH3COOH为弱酸,在25℃时将pH=12的NaOH溶液与pH=2的CH3COOH溶掖等体积混合时,醋酸过量,反应后的溶液中有n(Na+)=0.01mol,n(CH3COO-)+n(CH3COOH)>0.01mol,则c(Na+)<c(CH3COO-)+c(CH3COOH),故C错误;
D.任何溶液中都满足电荷守恒,所以溶液中一定满足:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),所以c(H+)<c(CH3COO-)+c(OH-),故D错误;
故选B.
B.在25℃时将pH=12的NaOH溶液与pH=2的CH3COOH溶液等体积混合时,醋酸过量,溶液呈酸性,则有c(CH3COO-)>c(Na+),c(H+)>c(OH-),由于H+离子与OH-离子反应,则溶液中c(Na+)>c(H+),所以溶液中离子浓度大小为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故B正确;
C.设溶液的体积都为1L,CH3COOH为弱酸,在25℃时将pH=12的NaOH溶液与pH=2的CH3COOH溶掖等体积混合时,醋酸过量,反应后的溶液中有n(Na+)=0.01mol,n(CH3COO-)+n(CH3COOH)>0.01mol,则c(Na+)<c(CH3COO-)+c(CH3COOH),故C错误;
D.任何溶液中都满足电荷守恒,所以溶液中一定满足:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),所以c(H+)<c(CH3COO-)+c(OH-),故D错误;
故选B.
点评:本题考查溶液离子浓度的大小比较、酸碱混合的定性判断,本题难度中等,注意掌握溶液酸碱性与溶液pH的关系,明确醋酸为弱电解质,pH=12的NaOH溶液与pH=2的CH3COOH溶掖等体积混合后,溶液中醋酸过量,溶液呈酸性;能够根据电荷守恒、物料守恒、盐的水解原理等知识比较溶液中离子浓度大小.

练习册系列答案
相关题目
下列各组物质不能按“→”所示关系实现转化的是(“→”表示反应一步完成)( )
A、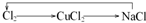 |
B、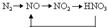 |
| C、S→SO2→H2SO4→MgSO4 |
| D、Al→Al2O3→Al(OH)3→NaAlO2 |
下列变化过程中,所需克服的作用力均相同的是( )
| A、水气化 氯化钠熔化 |
| B、干冰升华 加热氯化铵 |
| C、过氧化氢加入二氧化锰制氧气 碘化氢气体受热分解 |
| D、大理石高温生成二氧化碳,碘晶体升华为碘蒸气 |
葡萄糖是一种单糖的主要原因是( )
| A、在糖类结构中最简单 |
| B、不能再水解生成更简单的糖 |
| C、分子中含有一个醛基 |
| D、在所有糖类中碳原子数最少 |
人类最早大量使用的金属是( )
| A、金 | B、银 | C、铜 | D、铁 |
甲、乙、丙、丁四种短周期主族元素,它们的价电子数依次增大,乙形成的化合物种类最多,甲与乙的原子序数之和等于丁的原子序数,丙和乙位于同一周期,丁和乙位于不同周期.则下列说法中正确的是( )
| A、甲、乙、丙形成的化合物既有离子键又有共价键 |
| B、乙、丙、丁形成的氢化物常温下均为气体 |
| C、原子序数由小到大顺序为:甲<乙<丙<丁 |
| D、原子半径大小顺序为:丁>甲>乙>丙 |
某无色溶液中只可能溶有NH4+、K+、Al3+、Mg2+、HCO3-、Cl-、I-、MnO4-、SO42-等离子中的几种离子.为分析其组成,现进行如下实验:
①取10mL该溶液于试管中滴加足量的Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.03mol白色沉淀甲.
②取上述反应后的滤液,加入AgNO3溶液未见沉淀产生.
③另取10mL该溶液于试管中,滴加NaOH溶液产生白色沉淀乙,当加入NaOH的物质的量为0.03mol时,沉淀的量达到最大;继续滴加NaOH溶液并加热,开始产生气体丙,收集气体丙,换算成标况下为0.224L(假设丙全部逸出),最后沉淀完全溶解.
则下列说法正确的是( )
①取10mL该溶液于试管中滴加足量的Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.03mol白色沉淀甲.
②取上述反应后的滤液,加入AgNO3溶液未见沉淀产生.
③另取10mL该溶液于试管中,滴加NaOH溶液产生白色沉淀乙,当加入NaOH的物质的量为0.03mol时,沉淀的量达到最大;继续滴加NaOH溶液并加热,开始产生气体丙,收集气体丙,换算成标况下为0.224L(假设丙全部逸出),最后沉淀完全溶解.
则下列说法正确的是( )
| A、仅由实验①可推出肯定含有SO42-,不含Cl- |
| B、该无色溶液肯定含有NH4+、K+、Al3+、SO42- |
| C、该无色溶液肯定不含K+、Mg2+、HCO3-、Cl-、MnO4-、I- |
| D、不能确定该无色溶液是否含有K+ |
绿原酸的结构简式如图,下列有关绿原酸的说法不正确的是( )
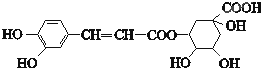
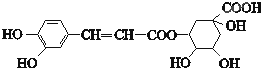
| A、分子式为C16H18O9 |
| B、0.1mol绿原酸最多与0.8mol NaOH反应 |
| C、能发生取代反应和消去反应 |
| D、能与Na2CO3反应 |
下列反应的离子方程式书写正确的是( )
| A、少量SO2气体通入到NaClO溶液中:SO2+ClO-+H2O═SO42-+Cl-+2H+ |
| B、把Fe(OH)3溶于氢氟酸:Fe(OH)3+3H+═Fe3++3H2O |
| C、向H218O中投入Na2O2固体:2H218O+2Na2O2═4Na++4OH-+18O2↑ |
| D、在苯酚钠溶液中通入少量的二氧化碳气体:C6H5O-+CO2+H2O═C6H5OH+HCO3- |