题目内容
5.下列实验操作或对实验事实的描述中,正确的是④(填序号).①为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化
②化学药品着火,都要立即用水或泡沫灭火器灭火
③配制一定物质的量浓度的稀硫酸溶液时,量取浓硫酸后的量筒要用蒸馏水洗涤,并把洗涤液转入容量瓶中
④配制一定物质的量浓度的溶液定容时,俯视容量瓶的刻线,会使配制的浓度偏高
⑤向溶液中加入盐酸酸化的BaCl2溶液,产生白色沉淀,说明一定含有SO42-
⑥检验红砖中的红色物质是否是Fe2O3的操作步骤为:样品→粉碎→加水溶解→过滤→向滤液中滴加KSCN溶液.
分析 ①氢氧化钠可与二氧化硅反应;
②根据化学药品的性质来判断灭火方法;
③量筒是流量式仪器,量筒在制作时就已经扣除了粘在量筒壁上的液体,量取的液体倒出的量就是所读的量程;
④俯视容量瓶的刻度线,则溶液体积偏小;
⑤能和盐酸酸化的BaCl2溶液产生白色沉淀的除了SO42-,还有Ag+;
⑥Fe2O3不溶于水.
解答 解:①瓷坩埚的主要成分是二氧化硅,加热条件下二氧化硅可与氢氧化钠反应生成硅酸钠,导致坩埚炸裂,故①错误;
②化学药品着火,像钠着火就不能用水或泡沫灭火器灭火,故②错误;
③量筒是流量式仪器,量筒在制作时就已经扣除了粘在量筒壁上的液体,量取的液体倒出的量就是所读的量程,不能洗涤,如果洗涤并洗涤液一并转移至烧杯,实际量取浓硫酸的体积偏大,所配溶液的浓度偏高,故③错误;
④俯视容量瓶的刻度线,则溶液体积偏小,浓度偏高,故④正确;
⑤能和盐酸酸化的BaCl2溶液产生白色沉淀的除了SO42-,还有Ag+,故不能说明一定含有SO42-,故⑤错误;
⑥Fe2O3不溶于水,故在水中不能电离出Fe3+,向滤液中滴加KSCN溶液无现象,故⑥错误.
故答案为:④.
点评 本题考查较为综合,涉及物质的分离、加热、检验等操作,侧重于学生的分析能力和实验能力的考查,为高频考点,注意把握物质的性质以及实验的严密性、可行性的评价,注意相关基础知识的学习,难度不大.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
16.下列反应中均可在溶液中进行,能用同一离子方程式表示的是( )
| A. | NaHCO3、Na2CO3分别与盐酸反应 | B. | NaOH、Cu(OH)2分别与硫酸反应 | ||
| C. | Ca(OH)2、CaCl2分别与Na2CO3反应 | D. | Ba(NO3)2、Ba(OH)2分别与稀硫酸反应 |
13.下列数量的各物质所含原子数按由大到小的顺序排列是( )
①0.45mol氨气 ②标准状况下33.6L氦气 ③4℃时7.5mL水 ④0.2mol磷酸钠(Na3PO4)
①0.45mol氨气 ②标准状况下33.6L氦气 ③4℃时7.5mL水 ④0.2mol磷酸钠(Na3PO4)
| A. | ①④②③ | B. | ②①④③ | C. | ②①③④ | D. | ①④③② |
20.等物质的量的下列物质在一定条件下与足量浓硝酸反应生成NO2,消耗硝酸的物质的量最多的是( )
| A. | Ag | B. | FeI2 | C. | SO2 | D. | C |
10.下列关于有机物的说法或表述中不正确的是( )
| A. | 等质量的乙烷、乙烯、乙炔在氧气中完全燃烧,乙烷消耗的氧气最多 | |
| B. | 可借助于核磁共振氢谱区分乙醇和二甲醚这两种物质 | |
| C. | CH3CH(CH3)CH(CH3)CH(C2H5)CH2CH3的名称:2,3-二甲基-4-乙基己烷 | |
| D. | 石油裂解是高分子生成小分子的过程 |
17.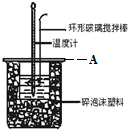 分别取40mL 的0.50mol/L盐酸与 0.55mol/L NaOH溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
分别取40mL 的0.50mol/L盐酸与 0.55mol/L NaOH溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
(1)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式NaOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O (l)△H=-57.3 kJ/mol;
(2)A为泡沫塑料板,上面有两个小孔,分别插入温度计和环形玻璃棒,两个小孔不能开得过大,其原因是减少热量散失;反应需要测量温度,每次测量温度后都必须用水将温度计上的液体冲掉,并擦干温度计;
(3)假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4.18J/(g•℃).实验时,还需测量的数据有ACE;
A.反应前盐酸溶液的温度 B.反应前盐酸溶液的质量
C.反应前氢氧化钠溶液的温度 D.反应前氢氧化钠溶液的质量
E.反应后混合溶液的最高温度 F.反应后混合溶液的质量
(4)某学生实验记录数据如下:
依据该学生的实验数据计算,该实验测得的中和热为△H=-51.8kJ/mol;
(5)假定该学生的操作完全同上,实验中改用100mL 0.50mol/L盐酸跟100mL0.55mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量不相等(填“相等”或“不相等”),所求中和热相等(填“相等”或“不相等”).
 分别取40mL 的0.50mol/L盐酸与 0.55mol/L NaOH溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
分别取40mL 的0.50mol/L盐酸与 0.55mol/L NaOH溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:(1)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式NaOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O (l)△H=-57.3 kJ/mol;
(2)A为泡沫塑料板,上面有两个小孔,分别插入温度计和环形玻璃棒,两个小孔不能开得过大,其原因是减少热量散失;反应需要测量温度,每次测量温度后都必须用水将温度计上的液体冲掉,并擦干温度计;
(3)假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4.18J/(g•℃).实验时,还需测量的数据有ACE;
A.反应前盐酸溶液的温度 B.反应前盐酸溶液的质量
C.反应前氢氧化钠溶液的温度 D.反应前氢氧化钠溶液的质量
E.反应后混合溶液的最高温度 F.反应后混合溶液的质量
(4)某学生实验记录数据如下:
| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 氢氧化钠 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
(5)假定该学生的操作完全同上,实验中改用100mL 0.50mol/L盐酸跟100mL0.55mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量不相等(填“相等”或“不相等”),所求中和热相等(填“相等”或“不相等”).
14.下列图示实验操作中,正确的是( )
| A. |  | B. |  | C. |  | D. |  |
14.25℃时,弱酸的电离平衡常数如下表:
下列有关说法正确的是( )
| 弱酸 | CH3COOH | HCN | H2CO3 |
| Ka | 1.8×10-5 | 4.9×10-10 | K1:4.3×10-7 K2:5.6×10-11 |
| A. | 等物质的量浓度的各溶液的pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) | |
| B. | a mol/L HCN与a mol/L NaOH溶液等体积混合后所得溶液呈中性 | |
| C. | 往冰醋酸中逐滴加水稀释,溶液导电能力始终保持减小 | |
| D. | 等浓度Na2CO3溶液的碱性比NaHCO3溶液的碱性强 |