题目内容
【题目】常温下,向20 mL 0.1mol·L-1的盐酸中逐滴加入0.1 mol·L-1的氨水,溶液pH的变化与加入氨水的体积关系如图所示。下列叙述不正确的是
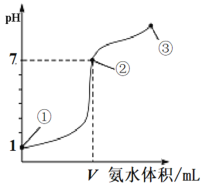
A.V>20 mL
B.①、②、③点水的电离程度大小为:②>③>①
C.在点②所示溶液中:c(Cl-)=c(NH3·H2O)+c(NH![]() )
)
D.在点②、③之间可能存在:c(NH![]() )>c(Cl-)=c(OH-)>c(H+)
)>c(Cl-)=c(OH-)>c(H+)
【答案】C
【解析】
A. 当盐酸和氨水恰好完全反应后,得到氯化铵溶液,由于氯化铵水解可以使溶液显酸性,因此,当两者混合后的溶液的pH=7时,氨水过量,故V>20 mL,A叙述正确;
B. ①为0.1mol·L-1的盐酸,其对水的电离有抑制作用;②③均为氯化铵和氨水的混合液,其中c(NH3H2O)均小于0.1mol·L-1,由于②的pH=7、而③的pH>7。盐酸和氨水均可抑制水的电离,但是盐酸是强酸而氨水为弱碱的溶液,在浓度相同时,盐酸对水的电离的抑制作用较强,氨水对水的电离的抑制作用越弱;氯化铵水解促进水的电离,因此,水的电离程度由大到小的顺序为②>③>①,B叙述正确;
C. 在氯化铵溶液中,存在物料守恒c(Cl-)=c(NH3·H2O)+c(NH![]() );②为氯化铵和氨水的混合液,因此,在点②所示溶液中c(Cl-)<c(NH3·H2O)+c(NH
);②为氯化铵和氨水的混合液,因此,在点②所示溶液中c(Cl-)<c(NH3·H2O)+c(NH![]() ),C叙述不正确;
),C叙述不正确;
D. 在点②存在电荷守恒c(NH![]() )+ c(H+)=c(OH-)+c(Cl-),因为溶液呈中性,c(H+)=c(OH-),则c(NH
)+ c(H+)=c(OH-)+c(Cl-),因为溶液呈中性,c(H+)=c(OH-),则c(NH![]() )=c(Cl-);在点②、③之间氨水用量变大,溶液呈弱碱性,c(NH
)=c(Cl-);在点②、③之间氨水用量变大,溶液呈弱碱性,c(NH![]() )和c(OH-)逐渐增大,c(Cl-)逐渐减小,因此可能存在c(NH
)和c(OH-)逐渐增大,c(Cl-)逐渐减小,因此可能存在c(NH![]() )>c(Cl-)=c(OH-)>c(H+),D叙述正确。
)>c(Cl-)=c(OH-)>c(H+),D叙述正确。
本题答案为C。

 同步奥数系列答案
同步奥数系列答案【题目】X、Y、Z、W为短周期主族元素,它们的最高正化合价和原子半径如下表所示:
元素 | X | Y | Z | W |
最高正化合价 | +3 | +1 | +5 | +7 |
原子半径 | 0.082 | 0.186 | 0.110 | 0.099 |
则下列说法错误的是
A.X的最高价氧化物对应的水化物具有两性
B.ZW3分子中所有原子最外层均满足8e-结构
C.Y的一种氧化物可用作供氧剂,Z的一种氧化物可用作干燥剂
D.简单气态氢化物的热稳定性:W>Z>X
【题目】(NH4)2Fe(SO4)2·6H2O俗称摩尔盐(M=392g·mol-1)是分析化学中重要的标准物质,某研究小组拟采用硫铁矿焙烧后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)为原料制取摩尔盐,设计了如下流程:
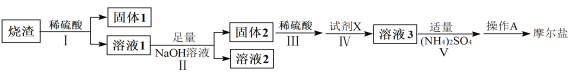
(1)写出试剂X的化学式__________。
(2)写出“溶液1”中某种离子与NaOH反应生成“溶液2”中离子的离子方程式________。
(3)操作A为蒸发浓缩至_________、冷却结晶、过滤、洗涤、干燥。其中过滤操作可用如图装置进行,请选择合适的编号,按正确的操作顺序补充完整(洗涤操作只需考虑一次):开抽气泵→a→b→d→_________→d→c→关抽气泵。
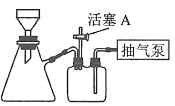
a.转移固液混合物
b.关活塞A
c.开活塞A
d.确认抽干
e.加洗涤剂洗涤
(4)实验制得的摩尔盐的纯度可用Ce(SO4)2标准溶液滴定进行测定。滴定反应为Fe2++Ce4+=Fe3++Ce3+。测定时,先称取4.000g样品,配成100mL溶液,取出其中20.00mL放入锥形瓶中,对溶液进行必要处理后,用0.1000mol·L-1Ce(SO4)2标准溶液滴定至终点,记录数据如下表:
滴定次数 | 0.1000mol·L-1Ce(SO4)2标准溶液体积(mL) | |
滴定前读数 | 滴定后读数 | |
1 | 0.10 | 20.12 |
2 | 0.12 | 20.10 |
3 | 0.05 | 21.65 |
①产品中摩尔盐的纯度为__________(用质量分数表示,保留4位有效数字)。
②若滴定过程中没有润洗滴定管,则会造成样品纯度______(填“偏高”、“偏低”或“无影响”)