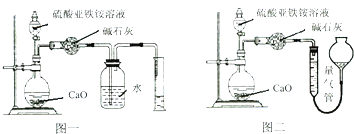
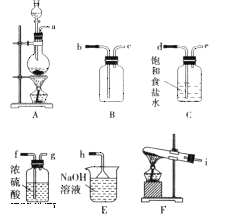
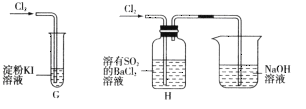
题目内容
【题目】配制500 mL0.5mol/LNaOH溶液,试回答下列问题:
(1)需要称取NaOH固体的质量为___;
(2)配制方法:设计五个操作步骤,请在横线上填上合适的仪器名称
①向盛有NaOH的烧杯中加入100mL蒸馏水使其溶解,并冷却至室温。
②将NaOH溶液沿___注入___中。
③在烧杯中加入少量的蒸馏水,小心洗涤___2~3次并把每次的洗涤液都转移入___。
④继续往___中加蒸馏水至液面接近刻度线1~2cm。
⑤改用___滴加蒸馏水至刻度线,盖好摇匀。
(3)以下操作会使实际配制NaOH溶液的浓度偏低的有___。
A.定容时俯视刻度线 B.溶解后的烧杯未经洗涤
C.称量用的烧杯不干燥 D.容量瓶中原来存有少量蒸馏水
【答案】10.0g 玻璃棒 500mL容量瓶 烧杯和玻璃棒 500mL容量瓶 500mL容量瓶 胶头滴管 B
【解析】
(1)计算出氢氧化钠的物质的量,再求出氢氧化钠的质量;
(2)②用玻璃棒引流到容量瓶中,注意容量瓶的容积;
③必须对烧杯和玻璃棒碱性洗涤;洗涤液转移到容量瓶中;
④向容量瓶中继续加蒸馏水;
⑤用胶头滴管定容;
(3)根据c=![]() 分析误差。
分析误差。
(1)需要氢氧化钠的物质的量是:0.5mol/L×0.5L=0.25mol,氢氧化钠的质量为:40g/mol×0.25mol=10.0g;
(2)②将NaOH溶液沿着玻璃棒引流到500mL容量瓶中;
③转移完烧杯中溶解的溶液后,必须对烧杯和玻璃棒减小洗涤,洗涤后的溶液也要转移到500mL容量瓶中;
④再继续向500mL容量瓶中加蒸馏水,至液面接近刻度线1~2cm;
⑤定容时用胶头滴管定容;
(3)A.定容时俯视刻度线,会导致配制的溶液的体积偏小,浓度偏高,故A错误;
B.溶解后的烧杯未经洗涤,导致配制的溶液中溶质的物质的量偏小,浓度偏小,故B正确;
C、称量氢氧化钠利用的是总质量和小烧杯的质量差,所以称量用的烧杯不干燥,不影响结果,故C错误;
D.容量瓶中有水,不影响配制结果,故D错误;
故答案为B。

【题目】X、Y、Z、W是元素周期表中的短周期元素,它们的相对位置如下表所示,其中X、Y 元素均能形成10电子的氢化物,Z的原子序数是Y的2倍。请回答下列问题:
X | Y | |
Z | W |
(1)W的简单离子的结构示意图为______,Y元素在周期表中的位置是____。
(2)写出实验室制W元素单质的离子方程式:___________
(3)关于W同主族元素,下列说法正确的是:__________
A.从上到下密度逐渐增大
B.从上到下熔点和沸点都逐渐升高
C.从上到下元素的非金属性越来越强
D.同主族元素对应的单质中,只有W元素对应的单质在常态下为气态
(4)W与Z形成的液体化合物Z2W2,该物质可与水反应生成ZO2气体,1 mol Z2W2参加反应时转移1.5 mol电子,其中只有一种元素化合价发生改变,Z2W2与水反应的化学方程式为_____。