题目内容
5.向足量的浓氢氧化钠溶液和足量的盐酸溶液中分别投入铝粉,充分反应后放出等量的氢气,则两个溶液中参加反应的铝的质量之比为( )| A. | 1:3 | B. | 3:1 | C. | 1:1 | D. | 1:2 |
分析 铝与酸、碱反应的化学方程式:2Al+6HCl=2AlCl3+3H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,等质量的Al分别和足量稀盐酸、NaOH反应,生成氢气的量与铝的质量有关,据此分析解答.
解答 解:由铝与酸、碱反应的化学方程式:2Al+6HCl=2AlCl3+3H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,2mol铝无论是与盐酸反应还是与氢氧化钠溶液反应,均生成3mol氢气,故当生成等量的氢气时,消耗的铝的量相等,即为1:1,
故选C.
点评 本题考查化学方程式有关计算,侧重考查学生分析计算能力,因为酸碱足量,根据铝的量计算即可,如果酸碱的物质的量相等,铝足量,则二者生成的氢气量不等,为易错点.

练习册系列答案
相关题目
15.下列物质中互为同系物的是( )
| A. | CH3-CH3CH3-CH2-CH3 | B. | 白磷、红磷 | ||
| C. | 氕、氚 | D. | 丁烷,异丁烷 |
16.体积为VmL,密度为dg•cm-3的溶液,含有相对分子质量为M的溶质mg,其物质的量浓度为cmol•L-1,质量分数为w,下列表达式正确的是( )
| A. | c=$\frac{w×1000×d}{M}$ | B. | m=V×d×$\frac{w}{100}$ | C. | w=$\frac{c×M}{1000×d}$% | D. | c=$\frac{1000×m}{V×M}$ |
13.设NA代表阿伏加德罗常数,下列说法不正确的是( )
| A. | 常温常压下,2g氮气所含分子数为NA | |
| B. | 0.5 molNa2SO4溶液中所含Na+数为NA | |
| C. | 标准状况下,22.4LNH3所含原子数为NA | |
| D. | 6.5g锌与足量盐酸反应生成氢气0.1NA |
20.下列有关氯水的叙述,不正确的是( )
| A. | 将氯水滴入紫色石蕊溶液中,可以看到先变红后褪色 | |
| B. | 将氯水滴入硝酸银溶液,有白色沉淀生成 | |
| C. | 向氯水中滴加碳酸钠溶液,有气体产生 | |
| D. | 向氯水中滴加溴化钾溶液,下层出现橙红色 |
10.有四种基团:-CH3、-OH、 、-COOH,它们两两组成的化合物中,能与氢氧化钠溶液反应的物质种类有( )
、-COOH,它们两两组成的化合物中,能与氢氧化钠溶液反应的物质种类有( )
 、-COOH,它们两两组成的化合物中,能与氢氧化钠溶液反应的物质种类有( )
、-COOH,它们两两组成的化合物中,能与氢氧化钠溶液反应的物质种类有( )| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
17.下列实验符合安全要求且能达到实验目的是( )
| A. | 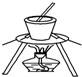 从食盐水中提取NaCl | B. | 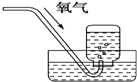 收集氧气 | ||
| C. | 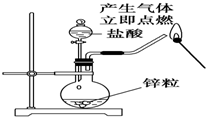 制备并检验氢气的可燃性 | D. | 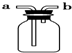 从a口进气可收集H2 |
6.下列有关说法正确的是( )
| A. | Na2O、Na2O2组成元素相同,与CO2反应产物也相同 | |
| B. | 含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1 mol•L-1 | |
| C. | Na的金属活动性比Mg强,故可用Na与MgCl2溶液反应制Mg | |
| D. | 1molNa2O2固体中含离子总数为3NA |