题目内容
4.下列关于电离常数的说法正确的是( )| A. | 电离常数随着弱电解质的浓度增大而增大 | |
| B. | CH3COOH的电离常数表达式为Ka=$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}$ | |
| C. | CH3COOH溶液中加入少量CH3COONa溶液,电离常数减小 | |
| D. | 电离常数只与温度有关,与浓度无关 |
分析 A、电离平衡常数是温度的函数;
B、CH3COOH的电离常数表达式为Ka=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$;
C、电离平衡常数是温度的函数;
D、电离平衡常数(K)是温度的函数,随温度的增大而增大,不随浓度的变化而变化.
解答 解:A、电离平衡常数是温度的函数,温度一定电离常数一定,与浓度无关,故A错误;
B、CH3COOH的电离常数表达式为Ka=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$,故B错误;
C、电离平衡常数是温度的函数,加入少量CH3COONa溶液,电离常数不变,故C错误;
D、电离平衡常数(K)是温度的函数,随温度的增大而增大,不随浓度的变化而变化,所以电离常数只与温度有关,与浓度无关,故D正确;
故选D.
点评 本题考查了电离平衡常数,注意电离平衡常数(K)是温度的常数,题目难度不大.

练习册系列答案
相关题目
15.能用H++OH-═H2O来表示的化学反应是( )
| A. | 氢氧化镁和稀盐酸反应 | B. | Ba(OH)2溶液滴入稀硫酸中 | ||
| C. | 澄清石灰水和稀硝酸反应 | D. | 醋酸溶液滴入氢氧化钠溶液中 |
19.在19题中发生的化学反应为:2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O 反应中,被氧化盐酸和未被氧化盐酸的物质的量之比是( )
| A. | 1﹕10 | B. | 10﹕1 | C. | 3﹕5 | D. | 5﹕3 |
9.喷水溶液法是科学家近期研制出的一种使沙漠变绿洲的新技术.它是先在沙漠中喷洒一定量的聚丙烯酸酯(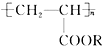 )“水溶液”,“水溶液”中的高分子化合物与沙土粒子相结合,在地表下30~50cm处形成一个厚0.5cm的隔水层,既能阻止地下的盐分上升,又有拦截蓄积雨水的作用.下列关于聚丙烯酸酯的说法中,不正确的是( )
)“水溶液”,“水溶液”中的高分子化合物与沙土粒子相结合,在地表下30~50cm处形成一个厚0.5cm的隔水层,既能阻止地下的盐分上升,又有拦截蓄积雨水的作用.下列关于聚丙烯酸酯的说法中,不正确的是( )
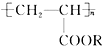 )“水溶液”,“水溶液”中的高分子化合物与沙土粒子相结合,在地表下30~50cm处形成一个厚0.5cm的隔水层,既能阻止地下的盐分上升,又有拦截蓄积雨水的作用.下列关于聚丙烯酸酯的说法中,不正确的是( )
)“水溶液”,“水溶液”中的高分子化合物与沙土粒子相结合,在地表下30~50cm处形成一个厚0.5cm的隔水层,既能阻止地下的盐分上升,又有拦截蓄积雨水的作用.下列关于聚丙烯酸酯的说法中,不正确的是( )| A. | 合成它的小分子化合物是CH3-CH2-COOR | |
| B. | 它可由CH2═CH-COOR经过加成聚合反应而得到 | |
| C. | 在一定条件下能发生水解反应 | |
| D. | 不能发生加成反应 |
16.下列离子方程式不正确的是( )
| A. | Fe2O3与稀HNO3反应的离子方程式为:Fe2O3+6H+═2Fe3++3H2O | |
| B. | 用稀H2SO4除去铜绿:4H++Cu2(OH)2CO3═2Cu2++CO2↑+3H2O | |
| C. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀:2Ba2++Al3++2SO42-+4OH-═AlO2-+2BaSO4↓+2H2O | |
| D. | 少量Ca(OH)2溶液与NaHCO3混合:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- |
13.下列实验操作或描述中正确的是( )
| A. | 用托盘天平称取5.85g氯化钠固体 | |
| B. | 提取碘水中的碘单质时,可选用酒精作萃取剂 | |
| C. | 观察钾元素焰色反应的操作是:将铂丝在稀盐酸中洗涤后直接蘸取固体氯化钾,置于酒精灯火焰上进行灼烧,根据火焰是否显紫色来确定 | |
| D. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
14.下列反应的离子方程式书写正确的是( )
| A. | 单质钠投入水中:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 纯碱溶液与盐酸反应:CO${\;}_{3}^{2-}$+2H+═CO2↑+H2O | |
| C. | 氢氧化铜与盐酸反应:H++OH-═H2O | |
| D. | 稀硫酸和氢氧化钡溶液反应:Ba2++OH-+H++SO${\;}_{4}^{2-}$═BaSO4↓+H2O |