题目内容
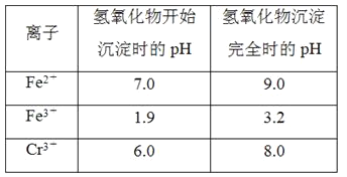
【题目】某一反应体系中的物质有HCl、SnCl2、H2SnCl6、As、H3AsO3、H2O,已知:HCl是反应物之一。
(1)①写出未配平的该反应的化学方程式:____→___
②在该反应中,得电子的物质是___,被氧化的元素是___。
③在反应中,每转移1 mol电子,消耗HCl___mol。
④下列叙述中正确的是___(填写字母序号)。
a.在相同条件下,第ⅦA族元素的阴离子的还原性从上到下逐渐增强
b.得电子越多的氧化剂,其氧化性越强
c.阳离子只能作氧化剂
d.在相同条件下,氧化性顺序:Fe3+>Cu2+>H+>Fe2+
(2)①向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。该反应的离子方程式为__,如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。该反应的化学方程式为___。
②把KI换成KBr,则CCl4层变为____色;继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是____。
③加碘盐中含碘量为20mg·kg-1~50 mg·kg-1。制取加碘盐(含KIO3的食盐)1000kg,若用KI与Cl2反应制KIO3,至少需要消耗Cl2____L(标准状况,保留2位小数)。
【答案】HCl+SnCl2+H3AsO3 H2SnCl6+As+H2O H3AsO3 Sn 2 a、d Cl2+2I-=I2+2Cl- 5Cl2+I2+6H2O=2HIO3+10HCl 橙 HBrO3>Cl2>HIO3 10.58
【解析】
(1) ① 已知HCl是反应物之一,说明其他物质中氯原子少的为反应物,氯原子多的为生成物,即SnCl2是还原剂,H3AsO3是氧化剂,所以反应方程式为:12HC1+3SnCl2+2H3AsO3
=3H2SnCl6+2As+6H2O。故答案为:HCl+SnCl2+H3AsO3;H2SnCl6+As+H2O;
② 根据反应方程式,得电子物质为H3AsO3,被氧化元素为Sn;故答案为:H3AsO3;Sn
③ 12 mol HCl参加反应共转移6 mol电子,故在反应中,每转移1 mol 电子消耗2 mol HCl;故答案为:2
④a、还原性与失电子能力强弱有关,半径越大,越容易失去最外层电子,还原性越强,在相同条件下第VIA族元素的阴离子随离子半径的增大还原性从上到下逐渐增强,故a正确;
b、氧化性强弱与得电子数目多少无关,与得电子能力强弱有关,得电子越多的氧化剂,其氧化性不一定越强,故b错误;
c、处于中间价态阳离子(如Fe2+)既可作氧化剂,又可作还原剂,故c错误;
d、在相同条件下氧化性顺序Fe3+>Cu2+>H+>Fe2+,故d正确;
答案选a、d;
(2) ①向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色,说明氯气和KI发生置换反应生成碘单质,反应方程式为:2KI+Cl2=2KCl+I2,如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色,说明碘和氯气发生氧化还原反应生成碘酸,氯气被还原生成HCl,反应方程式为I2+5Cl2+6H2O═2HIO3+10HCl,故答案为:2KI+Cl2=2KCl+I2;I2+5Cl2+6H2O═2HIO3+10HCl;
②氯气的氧化性比溴强,将KI换成KBr,则生成Br2,则CCl4层变为橙色;继续滴加氯水,CCl4层的颜色没有变化,说明氧化性HBrO3>Cl2,根据氧化剂和还原剂反应生成氧化产物和还原产物,氧化剂氧化性大于氧化产物的氧化性,则有Cl2>HIO3,所以氧化性顺序为HBrO3>Cl2>HIO3,故答案为:橙;HBrO3>Cl2>HIO3;
③由Cl2+2KI==I2+2KC1 和5Cl2+I2+6H2O==2HIO3+10HCI,两式合并:KI+3Cl2+3H2O=KIO3+6HCl,根据物料守恒得关系式KIO3~I~KI~3Cl2列比例求解: 3Cl2~ I,![]() ,解得V=10.58 L;
,解得V=10.58 L;
故答案为:10.58。