题目内容
【题目】三乙酸锰可作单电子氧化剂,用如下反应可以制取三乙酸锰:4Mn(NO3)2·6H2O+26(CH3CO)2O=4(CH3COO)3Mn+8HNO2+3O2↑+40CH3COOH。
(1)基态锰原子的价层电子排布式为____,其原子核外有_____种不同运动状态的电子,基态Mn3+含有的未成对电子数是_____。
(2)CH3COOH中碳原子的杂化形式为___。CH3COOH能与H2O以任意比互溶的原因是____。
(3)NO3-的空间构型是__,与NO3-互为等电子体的分子的化学式是____(任写一种)。
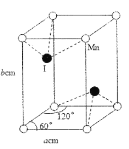
(4)碘与锰形成的某种化合物晶胞结构及参数如图所示,该化合物的化学式是___,晶胞密度p为___gcm3。伏伽德罗常数的数值用NA表示)
【答案】3d54s2 25 4 sp3或sp2 CH3COOH与H2O均为极性分子且分子间可形成氢键 平面三角形 BF3或BCl3或SO3 MnI2 ![]()
【解析】
(1)锰为25号元素,结合核外电子排布的规律书写基态锰原子的价层电子排布式及不同运动状态的电子数;根据基态Mn3+的价层电子排布式,结合洪特规则判断;
(2) 根据价层电子对个数=σ键个数+孤电子对个数依次分析CH3COOH中甲基上的碳原子和羧基上的碳原子的杂化方式;CH3COOH与H2O均为极性分子且分子间可形成氢键;
(3) 根据价层电子对个数=σ键个数+孤电子对个数分析NO3一中氮原子的杂化类型,再判断空间构型;根据等电子原理分析书写NO3-的等电子体;
(4)根据均摊法计算该化合物的化学式;根据晶胞数据计算其密度。
(1)锰是25号元素,位于周期表第四周期第ⅦB族,3d和4s上的电子是其价电子,根据构造原理知其价电子排布式为:3d54s2;其原子核外有25种不同运动状态的电子,基态Mn3+的价层电子排布式为3d4,含有4个未成对电子;
(2) CH3COOH中甲基上的碳原子含有4个σ键,没有孤电子对,采用sp3杂化,羧基上的碳原子含有3个σ键,没有孤电子对,采用sp2杂化;CH3COOH能与H2O以任意比互溶的原因是CH3COOH与H2O均为极性分子且分子间可形成氢键;
(3) NO3一中氮原子价层电子对数为3+![]() =3,N原子轨道的杂化类型为sp2,空间构型为平面三角形;NO3-中有4个原子,5+6×3+1=24个价电子,SO3中有4个原子,6+6×3=24个价电子,与NO3-是等电子体,BF3或BCl3等也与硝酸根离子为等电子体,故答案为:平面三角形;BF3或BCl3或SO3等;
=3,N原子轨道的杂化类型为sp2,空间构型为平面三角形;NO3-中有4个原子,5+6×3+1=24个价电子,SO3中有4个原子,6+6×3=24个价电子,与NO3-是等电子体,BF3或BCl3等也与硝酸根离子为等电子体,故答案为:平面三角形;BF3或BCl3或SO3等;
(4)根据均摊法可知,每个晶胞中含有8![]() =1个锰离子,2个碘离子,该化合物的化学式是MnI2,晶胞密度p为
=1个锰离子,2个碘离子,该化合物的化学式是MnI2,晶胞密度p为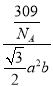 =
=![]() gcm3。
gcm3。

【题目】NF3是微电子工业中常用的一种等离子蚀刻气体,具有较强的氧化性,工业生产NF3常用的方法有气一液反应法、气一固反应法和电解法等。
(1)气一液反应法中发生的主反应和副反应包括:
3F2(g)+NH3(l)=NF3(g)+3HF(l) △H1
3F2(g)+NH4HF2(l)=NF3(g)+5HF(l) △H2
4F2(g)+2NH3(l)=N2F2(g)+6HF(l) △H3
NH3(l)+2HF(l)=NH4HF2(l) △H4
△H1=_____。部分键能数据如下表所示,△H3=_____kJ/mol。
化学键 | N-N | N=N | N | H-F | F-F | N-H | N-F |
键能(kJ/mol) | 159 | 456 | 946 | 565 | 153 | 389 | 272 |
(2)气一固反应法主要包括两步反应:
(NH4)3AlF6(s)+6F2(g)![]() 2NF3(g)+8HF(g)+NH4AlF4(s) 反应Ⅰ
2NF3(g)+8HF(g)+NH4AlF4(s) 反应Ⅰ
NH4AlF4(s)+3F2(g)![]() NF3(g)+4HF(g)+ AlF3(s) 反应Ⅱ
NF3(g)+4HF(g)+ AlF3(s) 反应Ⅱ
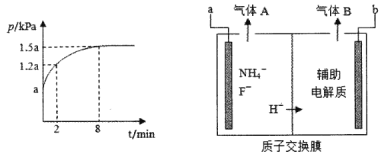
反应I的平衡常数K1和反应II的平衡常数的关系是___。若在恒温、恒容的密闭容器中模拟气一固反应法(固体足量),起始时F2的浓度为5mol/L,反应过程中容器中压强一随时间变化曲线如图所示,则前2min的平均反应速率v(NF3)=___mol/(Lmin),该温度下K2=___。
(3)电解法是通过电解含氟的熔融盐生产NF3,其原理如图所示。a需要接电源的____(填“正极”或“负极”),生成气体A的电极反应是____。
(4)用NF3对多晶硅电子元件进行蚀刻时不会在电子元件表面形成任何残留物,其原因是_____。(用化学用语解释)
【题目】电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数(25℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
①HCOONa、NaCN、NaHCO3、Na2CO3这4种溶液中阴离子结合质子能力最强的是__________________。
②体积相同、c(H+)相同的三种酸溶液①HCOOH;②HCN;③H2SO4分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填序号) _____________;
(2)一定浓度的NaCN溶液pH=9,用离子方程式表示呈碱性的原因是___________;此时c(HCN)/c(CN-)=______________。
(3)已知CaCO3的Ksp=2.8×l0-9,现将浓度为5.6×l0-4mol/LNa2CO3溶液与CaCl2溶液等体积混合,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为__________ mol/L。