题目内容
17.下列各组数据中,前者刚好是后者两倍的是( )| A. | 2mol/L Ba(OH)2溶液中Ba2+的物质的量和OH-的物质的量 | |
| B. | 200mL 1mol/L氯化钙溶液中c(Cl-)和100 mL 2mol/L氯化钾溶液中c(Cl-) | |
| C. | 20%NaOH溶液中NaOH的物质的量浓度和10%NaOH溶液中NaOH的物质的量浓度 | |
| D. | 64g二氧化硫中氧原子数和标准状况下22.4L一氧化碳中氧原子数 |
分析 A.氢氧化钡为强电解质,电离方程式:Ba(OH)2=Ba2++2OH-;
B.1 mol/L氯化钙溶液中c(Cl-)=2mol/L,2 mol/L氯化钾溶液中c(Cl-)=2mol/L;
C.氢氧化钠溶液浓度越大,密度越大,根据c=1000ρωM1000ρωM判断;
D.64g二氧化硫的物质的量为1mol,含有2mol氧原子;标况下22.4L一氧化碳的物质的量为1mol,含有1mol氧原子.
解答 解:A.氢氧化钡为强电解质,电离方程式:Ba(OH)2=Ba2++2OH-,Ba2+的物质的量和OH-的物质的量之比为1:2,故A错误;
B.溶液的浓度与体积无关,1 mol/L氯化钙溶液中c(Cl-)=2mol/L,2 mol/L氯化钾溶液中c(Cl-)=2mol/L,故B错误;
C.氢氧化钠溶液浓度越大,密度越大,根据c=1000ρωM1000ρωM可知,20%NaOH溶液物质的量浓度比10%NaOH溶液物质的量浓度的2倍大,故C错误;
D.64g二氧化硫的物质的量为64g64g/mol64g64g/mol=1mol,含有2mol氧原子;标况下22.4L一氧化碳的物质的量为1mol,含有1mol氧原子,故D正确,
故选:D.
点评 本题考查物质的量计算、物质的量浓度计算,难度不大,注意掌握物质的量浓度与质量分数之间关系.

练习册系列答案
相关题目
7.下列反应中必须加入还原剂才能进行的是( )
| A. | H2SO4→SO2 | B. | Zn2+→Zn | C. | H2O→H2 | D. | CuO→CuCl2 |
8.100mL三种盐的混合溶液中含有0.2mol Na+,0.25mol Mg2+,0.4mol Cl-,则SO42-浓度为( )
| A. | 1.5 mol•L-1 | B. | 1 mol•L-1 | C. | 0.15 mol•L-1 | D. | 3 mol•L-1 |
5.用酸式滴定管准确移取25.00mL某未知浓度的盐酸溶于一洁净的锥形瓶中,然后用0.2000mol•L -1的氢氧化钠溶液(指示剂为酚酞),滴定结果如下:
(1)根据以上数据可以计算出盐酸的物质的量浓度为0.1448mol•L-1.
(2)达到滴定终点的标志是无色变粉红色且30s不变色.
(3)以下操作造成测定结果偏高的原因可能是ADE.
A.配制标准溶液的氢氧化钠中混有Na2CO3杂质
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E.未用标准液润洗碱式滴定管.
| NaOH起始读数 | NaOH终点读数 | |
| 第一次 | 0.10mL | 18.60mL |
| 第二次 | 0.30mL | 18.00mL |
(2)达到滴定终点的标志是无色变粉红色且30s不变色.
(3)以下操作造成测定结果偏高的原因可能是ADE.
A.配制标准溶液的氢氧化钠中混有Na2CO3杂质
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E.未用标准液润洗碱式滴定管.
12.向H2SO4、CuCl2混合溶液中投入足量的铁粉,经充分反应后,过滤、洗涤、干燥、称重,知所得固体的质量与加入的铁粉的质量相等,则原溶液中c(SO42-)与c(Cl-)之比( )
| A. | 1:2 | B. | 1:7 | C. | 7:1 | D. | 1:14 |
2.根据表中信息判断,下列选项不正确的是( )
| 序列 | 参加反应的物质 | 生成物 |
| ① | Cl2、FeBr2 | FeCl3、FeBr3 |
| ② | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4 … |
| ③ | MnO4- … | Cl2、Mn2+ … |
| A. | 第①组反应中Cl2与 FeBr2的物质的量之比为1:2 | |
| B. | 第②组反应的其余产物为H2O和 O2 | |
| C. | 氧化性由强到弱顺序MnO4->Cl2>Fe3+>Br2 | |
| D. | 第③组反应中生成1mol Cl2,转移电子2mol |
7.下列离子方程式正确的是( )
| A. | 钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 氢氧化钡溶液滴入稀硫酸中:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| C. | 二氧化硫与足量氢氧化钠溶液反应 SO2+2OHˉ=SO32-+H2O | |
| D. | 铝与氢氧化钠溶液反应:Al+2OH-═2A1O−2−2+H2↑ |
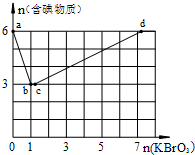 现向含6mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示.
现向含6mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示.