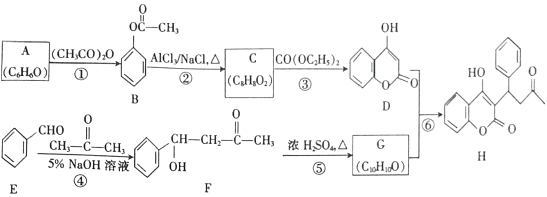
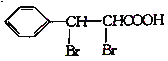
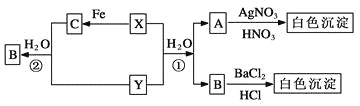
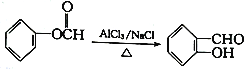题目内容
【题目】甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g) + CO(g)![]() CH3OH(g)
CH3OH(g)
(1)下表所列数据是该反应在不同温度下的化学平衡常数(K)
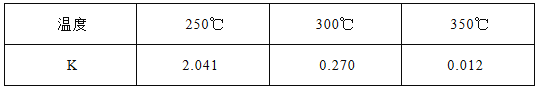
①该反应的熵变△S 0(填:“<,>,=”)。该反应在 (填:高温或低温)条件下能自发进行。
②要提高CO的转化率,可以采取的措施是_____________(填序号)。
a.升温
b.加入催化剂
c.增加CO的浓度
d.加入H2加压
e.加入惰性气体加压
f.分离出甲醇
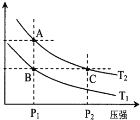
(2)如图表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A__________C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A___________C,由状态B到状态A,可采用___________的方法(填“升温”或“降温”)。
【答案】(1) ①<;低温② d f ;(2)<;=;升温
【解析】
试题分析:(1) ①由于该反应是气体分子数减小的反应,因此是熵减反应,故熵变△S<0;由于升高温度,平衡常数减小,化学平衡逆向移动,因此该反应正向放热,即△H<0,根据复合判据△G=△H-T△S<0时,反应自发进行,因此该反应在低温条件下能自发进行;②a.由于该反应是放热反应,因此升温平衡逆向移动,CO的转化率降低,a错误;b.加入催化剂能提高反应速率,但是平衡不移动,不能提高CO的转化率,b错误;c.增加CO的浓度平衡正向移动,H2的转化率提高,而CO自身的转化率降低,c错误;d.加入H2加压,平衡正向移动,CO的转化率增大,d正确;e.加入惰性气体加压,由于容器体积不变,因此各物质浓度不变,平衡不移动,不能提高CO的转化率,e错误;f.分离出甲醇,使平衡不断正向移动,CO的转化率增大,f正确;故答案d、f;(2)温度相同时,增大压强,反应速率增大,因此,反应速率,A<C;由于A、C两点的温度相同,因此平衡常数相等,即平衡常数A=C;由状态B到状态A,压强不变,H2的体积分数增大,证明平衡逆向移动,由于该反应逆向吸热,因此可采用升温的方法。