题目内容
【题目】已知X、Y为有刺激性气味的气体,有以下转化关系,部分产物未标出。
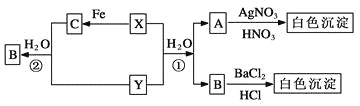
试回答:
(1)写出下列物质的化学式
X________、 Y________ 、A________ 、B______、 C________。
(2) 反应①的化学方程式为____________________________,
反应②的离子方程式为_______________________________。
【答案】(1) Cl2SO2HCl H2SO4FeCl3
(2) Cl2+SO2+2H2O === 2HCl+H2SO4 2Fe3++SO2+2H2O === 2Fe2++SO+4H+
【解析】
A与硝酸银溶液、稀硝酸反应生成白色沉淀可知A中含有Cl-,B与氯化钡溶液、盐酸生成白色沉淀可知B中含有SO42—;X、Y、H2O生成Cl-和SO42—且X、Y均是有刺激性气味的气体可推知X、Y是二氧化硫和氯气,反应为Cl2+SO2+2H2O=2HCl+H2SO4;X能与铁反应可知X为Cl2,则C为FeCl3、Y为SO2,二氧化硫通入氯化铁溶液生成氯化亚铁、硫酸和盐酸,则A为HCl,B为H2SO4,结合对应物质的性质以及题目要求解答该题。
根据以上分析可知A为HCl,B为H2SO4,C为FeCl3,X为Cl2,Y为SO2,则
(1)由以上分析可知X为Cl2,Y为SO2,A为HCl,B为H2SO4,C为FeCl3;
(2)反应①是氯气氧化二氧化硫,反应的化学方程式Cl2+SO2+2H2O=2HCl+H2SO4;反应②二氧化硫通入氯化铁溶液生成氯化亚铁、硫酸和盐酸,反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42—+4H+。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案【题目】下列实验方案能达到实验目的的是
实验目的 | 实验方案 | |
A | 检验Na2SO3晶体是否已氧化变质 | 将Na2SO3样品溶于稀硝酸后,滴加BaCl2溶液,观察是否有沉淀生成 |
B | 证明酸性条件下H2O2氧化性强于I2 | 向淀粉KI溶液中滴入3滴稀硫酸,未见溶液变蓝;再加入10%的H2O2溶液,溶液立即变蓝色 |
C | 制备氢氧化铁胶体 | 向沸水中滴加氯化铁稀溶液,继续煮沸至溶液呈红褐色 |
D | 证明Mg(OH)2沉淀可转化为Fe(OH)3沉淀 | 向2 mL1mol/L NaOH溶液中先加入3滴1mol/L MgCl2溶液,再加入3滴1mol/L FeCl3溶液 |
A. A B. B C. C D. D