题目内容
【题目】某同学做如下实验:
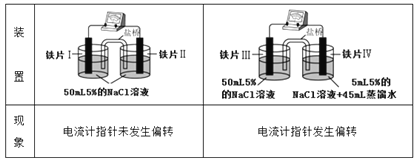
已知K3[Fe(CN)6]遇Fe2+生成深蓝色沉淀,则下列说法正确的是
A. “电流计指针未发生偏转”,说明铁片I、铁片II均未被腐蚀
B. 用K3[Fe(CN)6]溶液检验铁片III、IV附近溶液,可判断电池的正、负极
C. 铁片I、III所处的电解质溶液浓度相同,二者的腐蚀速率相等
D. 铁片IV的电极反应式为Fe-3e-=Fe3+
【答案】B
【解析】A、图1中因两溶液中氯化钠的浓度相等,因此发生的是普通的化学腐蚀,且腐蚀速率相等,电流计指针未发生偏转,铁片Ⅰ、铁片Ⅱ均被腐蚀,A错误;B、图2中因两溶液中氯化钠的浓度不相等,因此发生的是电化学腐蚀,且浓度大的一极发生的反应是Fe-2e-=Fe2+,可以用K3[Fe(CN)6]溶液检验亚铁离子的存在,进而判断电池的正、负极,B正确;C、自同一个原电池装置中,铁片Ⅰ、Ⅱ所处的电解质溶液浓度相同,二者的腐蚀速率相等,C错误;D、铁片Ⅳ的电极反应式为Fe-2e-=Fe2+,D错误;答案选B。

练习册系列答案
相关题目