题目内容
【题目】氯气是一种重要的工业原料。
(1)写出实验室制取氯气反应的化学方程式________________________。
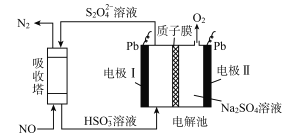
(2)资料显示:Ca(ClO)2 +CaCl2+2H2SO4![]() 2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
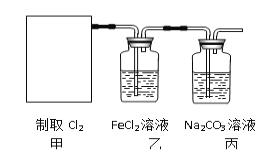
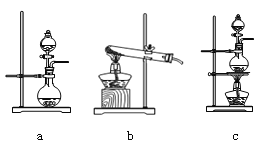
①在该实验中,甲部分的装置是_______(填字母)。
②乙装置中FeCl2溶液与Cl2反应的离子方程式是________________。
③丙装置中通入少量Cl2,可制得某种生活中常用的漂白、消毒的物质,这种物质是_______(化学式)。
④有人认为该实验存在明显的缺陷,如何改进:______________
请你写出Cl2和“④”中“最合适的化学试剂”反应的离子方程式______________。
【答案】MnO2 + 4HCl(浓)![]() MnCl2 + Cl2↑+ 2H2O c 2Fe2++Cl2 = 2Fe3++2Cl- NaClO 增加尾气处理装置 Cl2+2OH-=Cl-+ClO-+H2O
MnCl2 + Cl2↑+ 2H2O c 2Fe2++Cl2 = 2Fe3++2Cl- NaClO 增加尾气处理装置 Cl2+2OH-=Cl-+ClO-+H2O
【解析】
(1)实验室利用二氧化锰在加热的条件下氧化浓盐酸制备氯气;
(2)①根据实验原理分析制备氯气的实验装置;
②氯气和氯化亚铁反应生成氯化铁,据此书写;
③氯气和碳酸钠溶液反应生成的次氯酸具有漂白性,据此判断;
④根据氯气具有毒性,能与氢氧化钠溶液反应分析。
(1)实验室利用二氧化锰在加热的条件下氧化浓盐酸制备氯气,则实验室制取氯气反应的化学方程式为MnO2+4HCl(浓)![]() MnCl2 +Cl2↑+2H2O。
MnCl2 +Cl2↑+2H2O。
(2)①根据反应Ca(ClO)2+CaCl2+2H2SO4![]() 2CaSO4+2Cl2↑+2H2O可知制备氯气属于液体和液体反应且需要加热,因此选择c装置,答案选c;
2CaSO4+2Cl2↑+2H2O可知制备氯气属于液体和液体反应且需要加热,因此选择c装置,答案选c;
②Fe2+具有还原性,氯气具有强氧化性,把Fe2+氧化成Fe3+,反应的离子反应方程式为2Fe2++Cl2=2Fe3++2Cl-;
③Cl2+H2O=HCl+HClO,HCl+Na2CO3=NaHCO3+NaCl,HClO+Na2CO3=NaClO+NaHCO3,次氯酸钠具有强氧化性,因此可制得某种生活中常用的漂白、消毒的物质,该物质的化学式为NaClO;
④氯气有毒,缺少尾气处理装置,处理氯气常用NaOH,发生反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O。