题目内容
9.一定质量的铁铝合金完全溶于过量的热浓硝酸中,反应中共产生13.44L的NO2(标况下),若在反应后的溶液中加入足量的氢氧化钠溶液,则生成沉淀的质量不可能为( )| A. | 7.8g | B. | 10.7g | C. | 15.6g | D. | 21.4g |
分析 一定质量的铁铝合金完全溶于过量的热浓硝酸中,反应生成Fe(NO3)3、Al(NO3)3,向反应后的溶液中加入足量的氢氧化钠溶液生成的沉淀为Fe(OH)3,假设全为Al,最终没有沉淀生成,假设金属全为Fe,最终得到沉淀质量增大,根据n=$\frac{V}{{V}_{m}}$计算NO2的物质的量,利用电子转移守恒计算金属的物质的量,进而计算沉淀的最大质量,据此确定沉淀质量范围.
解答 解:13.44L的NO2的物质的量为$\frac{13.44L}{22.4L/mol}$=0.6mol,反应生成Fe(NO3)3、Al(NO3)3,金属都为+3价,根据电子转移守恒,可知金属的总物质的量为$\frac{0.6mol×(5-4)}{3}$=0.2mol,
向反应后的溶液中加入足量的氢氧化钠溶液生成的沉淀为Fe(OH)3,假设全为Al,最终没有沉淀生成,假设金属全为Fe,最终得到沉淀质量增大,根据Fe原子守恒,可知生成0.2molFe(OH)3,Fe(OH)3的质量为0.2mol×107g/mol=21.4g,由于金属为Al、Fe的混合物,故沉淀的质量范围为:0g<m(沉淀)<21.4g,
故选:D.
点评 本题考查混合物的有关计算,难度中等,注意利用守恒思想与极限法进行的解答.

练习册系列答案
 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
相关题目
20.下表中的实验操作不能达到实验目的是( )
| 选项 | 实验操作 | 实验目的 |
| A | 向含有KSCN溶液的FeSO4溶液中滴加硫酸酸化的H2O2溶液 | 检验H2O2的氧化性大于Fe3+ |
| B | 将气体通入稀溴水中 | 检验SO2 中是否混有乙烯 |
| C | 滴入紫色石蕊试液 | 检验酒精中是否混有醋酸 |
| D | 用饱和碳酸钠溶液洗涤后分液 | 除去乙酸乙酯中少量的乙醇和乙酸 |
| A. | A | B. | B | C. | C | D. | D |
17.决定核素种类的是原子结构中的( )
| A. | 质子数 | B. | 最外层电子数 | C. | 质量数 | D. | 质子数和中子数 |
4.下列物质中,物质的量最大的是( )
| A. | 4g H2 | B. | 18mL H2O (4℃时) | C. | 23g Na+ | D. | 6.02×1023个O |
 二氧化氯被世界卫生组织(WHO)确认为第四代A1型消毒剂.
二氧化氯被世界卫生组织(WHO)确认为第四代A1型消毒剂.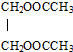 (过程中无机产物已忽略)
(过程中无机产物已忽略)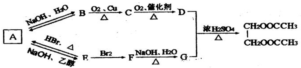 .
.