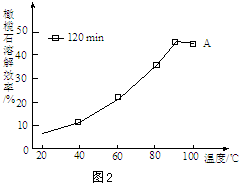
题目内容
9.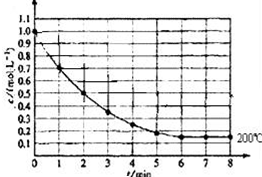 一固定体积的密闭容器中放入1molX(g)发生反应:X(g)?4Y(s)+Z(g),如图表示在 200℃时,X的浓度随时间变化的曲线.
一固定体积的密闭容器中放入1molX(g)发生反应:X(g)?4Y(s)+Z(g),如图表示在 200℃时,X的浓度随时间变化的曲线.(1)5min内用Z表示的平均反应速率为0.16mol/(L.min).
(2)该反应在6min时刻达到平衡.
(3)第7min时刻,V(正)=V(逆)(填“>”、“<”或“=”).
(4)下列说法能说明该反应已达平衡状态的是b、c、d、e(填编号).
a.相同时间内生成0.1molZ的同时,生成0.4molY
b.单位时间消耗0.1molX的同时,消耗0.4molY
c.反应体系中X或者Y或者Z的浓度保持不变
d.混合气体的平均摩尔质量不再变化.
e.反应速率 Vx(正)=$\frac{1}{4}$VY(逆)
分析 (1)根据v=$\frac{△c}{△t}$进行计算求解;
(2)由图可知,当6min时X 的物质的量浓度保持不变,反应达平衡状态;
(3)第7min时刻,达平衡状态;
(4)达平衡状态时正逆反应速率相等,各组分的浓度保持不变,由此分析解答.
解答 解:(1)v(X)=$\frac{△c}{△t}$=$\frac{1-0.2}{5}$=0.16mol/(L.min),而v(Z)=v(X)=0.16mol/(L.min),故答案为:0.16mol/(L.min);
(2)由图可知,当6min时X 的物质的量浓度保持不变,反应达平衡状态,故答案为:6min;
(3)第7min时刻,达平衡状态,V(正)=V(逆),故答案为:=;
(4)a.相同时间内生成0.1molZ的同时,生成0.4molY,都反映正反应的方向,故错误;
b.单位时间消耗0.1molX的等效于生成0.4molY的同时消耗0.4molY,正逆反应速率相等,达平衡状态,故正确;
c.反应体系中X或者Y或者Z的浓度保持不变,说明反应达平衡状态,故正确;
d.混合气体的平均摩尔质量不再变化,说明气体的质量不变,反应达平衡状态,故正确;
e.反应速率 Vx(正)=$\frac{1}{4}$VY(逆),则正逆反应速率相等,反应达平衡状态,故正确;故选b、c、d、e.
点评 本题考查化学平衡有关计算、化学平衡状态判断等知识点,为高频考点,明确反应方程式中各个物理量关系是解本题关键,题目难度不大.

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目
14.将下列物质分别加入到溴水中,溴水中溴单质的物质的量减少的是( )
| A. | KCl | B. | KBr | C. | CCl4 | D. | I2 |
12.下列有关胶体的说法正确的是( )
| A. | 将饱和FeCl3溶液逐滴滴加到NaOH溶液中,即可制得Fe(OH)3胶体 | |
| B. | FeCl3溶液是电中性的,Fe(OH)3胶体是带正电荷的 | |
| C. | 可利用丁达尔现象区别FeCl3溶液和Fe(OH)3胶体 | |
| D. | 将500mL 2mol/L FeCl3溶液制成胶体,胶粒的数目为NA |
14.下列叙述正确的是( )
| A. | SO2具有还原性,故可作漂白剂 | |
| B. | Na的金属活动性比Mg强,故可用Na与MgCl2溶液反应制Mg | |
| C. | 浓硝酸中的HNO3见光会分解,故有时在实验室看到的浓硝酸呈黄色 | |
| D. | CaCO3在水中的溶解度很小,故CaCO3为弱电解质 |
19.下列叙述正确的是( )
| A. | 向某溶液中加入Ba(NO3)2溶液和稀HNO3,有白色沉淀产生,则溶液中一定含有SO42- | |
| B. | 氯气和二氧化硫湿润时均有漂白作用,若将二者等物质的量混合溶于水,漂白效果会增强 | |
| C. | 将稀硫酸滴到淀粉碘化钾试纸上,一段时间后变蓝,有反应4H++4I-+O2=2I2+2H2O发生 | |
| D. | 将足量的CO2逐渐通入含等物质的量的Ba(OH)2和KOH的混合溶液中,生成沉淀的物质的量与CO2的关系如图: |
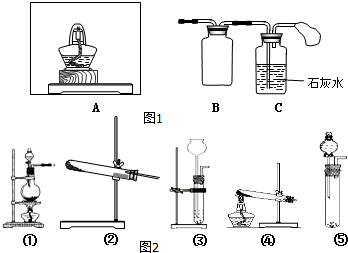 Na2O2是常见的氧化剂,某化学小组的同学欲通过以下实验确定炭粉与Na2O2反应的产物.
Na2O2是常见的氧化剂,某化学小组的同学欲通过以下实验确定炭粉与Na2O2反应的产物.
 .
.