题目内容
将4.368 g铁粉完全溶于150 mL 2.0 mol·L-1的稀HCl中,然后通入0.009 mol Cl2,再加入2.94 g重铬酸钾晶体(K2Cr2O7)恰好使溶液中的Fe2+全部转化为Fe3+,重铬酸钾被还原为铬的低价阳离子,已知K2Cr2O7的相对分子质量为294,试求产物中铬元素的化合价。
铬的化合价为+3
设产物中铬的化合价为x,根据得失电子守恒有:
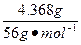 ×1="0.009" mol×2+
×1="0.009" mol×2+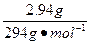 (6-x)×2,x=+3。
(6-x)×2,x=+3。
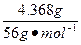 ×1="0.009" mol×2+
×1="0.009" mol×2+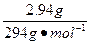 (6-x)×2,x=+3。
(6-x)×2,x=+3。
练习册系列答案
相关题目
 N2+H2O(未配平)。在该反应中,被氧化与被还原的氮原子数之比为( )
N2+H2O(未配平)。在该反应中,被氧化与被还原的氮原子数之比为( )