题目内容
【题目】某兴趣小组利用文献资料设计方案对氯及其化合物进行探究.
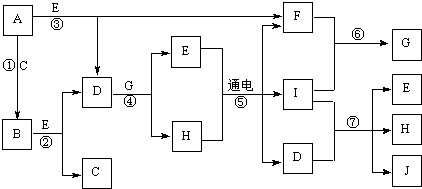
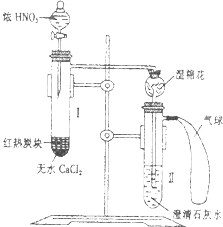
(1)Ⅰ.用高锰酸钾和浓盐酸反应制取氯气 a.该小组利用下图装置及试剂制备并收集适量Cl2 , 装置B、C的作用分别是、 . 
b.制得的氯气中加入适量水,得到饱和氯水,
饱和氯水中含氯元素的微粒有(写出全部微粒).
c.饱和氯水与石灰石的反应是制取较浓HC1O溶液的方法之一.在过量的石灰石中加入饱和氯水充分反应,有少量气泡产生,溶液浅黄绿色褪去,过滤,得到的滤液其漂白性比饱和氯水更强.
①滤液漂白性增强的原因是(用化学平衡移动原理解释).
②饱和氯水与石灰石反应生成HClO的方程式是 .
(2)ClO3﹣、Cl﹣和H+反应的探究 a.KClO3、KCl与硫酸可以反应.该小组设计了系列实验研究反应条件对反应的影响,实验记录如下(实验在室温下进行):
烧杯编号 | 1 | 2 | 3 | 4 |
氯酸钾饱和溶液 | 1mL | 1mL | 1mL | 1mL |
氯化钾固体 | 1g | 1g | 1g | 1g |
水 | 8mL | 6mL | 3mL | 0mL |
硫酸(6mol/L) | 0mL | 2mL | ()mL | 8mL |
现象 | 无现象 | 溶液呈浅黄色 | 溶液呈黄绿色,生成浅黄绿色气体 | 溶液呈黄绿色, |
①该系列实验的目的 .
②烧杯3取用硫酸的体积应为mL.
b.该小组同学查资料得知:将氯酸钾固体和浓盐酸混合也能生成氯气,同时有大量ClO2生成;ClO2沸点为10℃,熔点为﹣59℃,液体为红色;Cl2沸点为﹣34℃,液态为黄绿色.设计最简单的实验验证Cl2中含有ClO2 .
【答案】
(1)收集氯气;防止D中的溶液进入B;Cl﹣、Cl2、ClO﹣、HClO;氯水中存在平衡:Cl2+H2O?HClO+HCl,CaCO3与盐酸反应使平衡正移,增大HClO的浓度,漂白效果增强;CaCO3+2Cl2+H2O═2HC1O+CO2+CaCl2
(2)5;其他条件相同时,氢离子浓度不同对化学反应速率的影响;5;收集一试管气体,盖上胶塞,放入冰水混合物中,观察液体(或气体)颜色变化
【解析】解:(1)a.用高锰酸钾和浓盐酸反应制取氯气,氯气的密度比空气大,收集时采用B装置长进短出的方式,C是安全装置,防止D中的溶液进入B,所以答案是:收集氯气;防止D中的溶液进入B;b.新制的饱和氯水中存在H2O,Cl2 , HClO分子,存在H+ , OH﹣ , Cl﹣ , ClO﹣离子,含氯元素的微粒有:Cl﹣、Cl2、ClO﹣、HClO,
所以答案是:Cl﹣、Cl2、ClO﹣、HClO;c.①氯水中存在平衡:Cl2+H2OHCl+HClO,加入石灰石后,HCl与CaCO3反应浓度减小,使平衡向右移动,HClO浓度增大,漂白效果好,
所以答案是:氯水中存在平衡:Cl2+H2OHClO+HCl,CaCO3与盐酸反应使平衡正移,增大HClO的浓度,漂白效果增强;②氯水中含盐酸、次氯酸,加入石灰石后,HCl与CaCO3反应生成氯化钙、二氧化碳和水,总反应方程式为:CaCO3+2Cl2+H2O═2 HC1O+CO2+CaCl2 ,
所以答案是:CaCO3+2Cl2+H2O═2HC1O+CO2+CaCl2;(2)a.①从表中数据看出其他条件相同时,溶液的总体积相同,只有氢离子的浓度不同,得出本实验的目的为:其他条件相同时,氢离子浓度不同对化学反应速率的影响,
所以答案是:其他条件相同时,氢离子浓度不同对化学反应速率的影响;
②根据每组实验的总体积应相同计算出烧杯3取用硫酸的体积,实验1的总体积为1mL+8mL+0mL=9mL,所以烧杯3中硫酸的体积为:9mL﹣1mL﹣3mL=5mL,
所以答案是:5;b.根据ClO2沸点为10℃,熔点为﹣59℃,液体为红色,Cl2沸点为﹣34℃,液态为黄绿色,为验证Cl2中含有ClO2 , 收集一试管气体,盖上胶塞,放入冰水混合物中,观察液体(或气体)颜色变化,若出现红色,则说明Cl2中含有ClO2 ,
所以答案是:收集一试管气体,盖上胶塞,放入冰水混合物中,观察液体(或气体)颜色变化.

【题目】某实验小组设计用50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在如图装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: 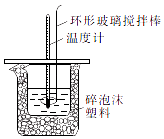
(1)环形玻璃搅拌棒的作用是 .
(2)中和反应放出的热量会造成少量盐酸在反应中挥发,则测得的中和热的数值(填“偏大”、“偏小”或“不变”).
(3)该实验小组做了三次实验,每次取溶液各50mL,并将实验数据记录如表:
实验序号 | 起始温度t1/℃ | 终止温度(t2)℃ | 温差(t2﹣t1)℃ | ||
盐酸 | NaOH溶液 | 平均值 | |||
1 | 25.1 | 24.9 | 25.0 | 31.8 | 6.8 |
2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
3 | 25.1 | 25.1 | 25.1 | 32.0 | 6.9 |
已知盐酸、NaOH溶液的密度与水相同,中和后生成的溶液的比热容c=4.18×10﹣3kJ/(g℃),则该反应的中和热△H= .
(4)在中和热测定实验中,测量起始温度时需要两个温度计,如果只用一个温度计测量,则测得的中和热的数值(填“偏大”、“偏小”或“不变”).