题目内容
【题目】某校为了改进碳与HNO3反应的实验,设计了如图所示的装置:先预热盛有无水CaCl2的试管I,然后投入几小块红热的炭块,再缓缓地向炭块上滴加浓HNO3 , 反应即可连续进行.
(1)由于浓HNO3易挥发,应怎样操作才能使分液漏斗中HNO3顺利滴下? .
(2)写出试管I中的化学方程式: .
(3)试管Ⅱ上方的长颈漏斗中放置一团湿棉花.其作用是 .
(4)试管Ⅱ中的现象: .
【答案】
(1)用导管连接分液漏斗和大试管
(2)C+4HNO3(浓) ![]() CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O
(3)将二氧化氮转化成一氧化氮
(4)产生气泡,澄清石灰水变浑浊
【解析】解:(1)用导管将分液漏斗和大试管连接,使分液漏斗和导管中压强相等,从而使分液漏斗中的浓硝酸顺利流出,
所以答案是:用导管连接分液漏斗和大试管;(2)试管I中C与浓硝酸反应的方程式为:C+4HNO3(浓) ![]() CO2↑+4NO2↑+2H2O,所以答案是:C+4HNO3(浓)
CO2↑+4NO2↑+2H2O,所以答案是:C+4HNO3(浓) ![]() CO2↑+4NO2↑+2H2O;(3)根据反应可知,反应生成的气体为二氧化碳和二氧化氮的混合物,要通过澄清石灰水证明二氧化碳,应该除去二氧化氮,湿棉花中的水分能够将二氧化氮转化成NO,从而避免了对二氧化碳的检验,所以答案是:将二氧化氮转化成一氧化氮;(4)NO不与澄清石灰水反应,所以会观察到有气泡冒出,二氧化碳与澄清石灰水反应生成碳酸钙沉淀,则澄清石灰水会变浑浊,所以答案是:产生气泡,澄清石灰水变浑浊.
CO2↑+4NO2↑+2H2O;(3)根据反应可知,反应生成的气体为二氧化碳和二氧化氮的混合物,要通过澄清石灰水证明二氧化碳,应该除去二氧化氮,湿棉花中的水分能够将二氧化氮转化成NO,从而避免了对二氧化碳的检验,所以答案是:将二氧化氮转化成一氧化氮;(4)NO不与澄清石灰水反应,所以会观察到有气泡冒出,二氧化碳与澄清石灰水反应生成碳酸钙沉淀,则澄清石灰水会变浑浊,所以答案是:产生气泡,澄清石灰水变浑浊.

 口算能手系列答案
口算能手系列答案【题目】某兴趣小组利用文献资料设计方案对氯及其化合物进行探究.
(1)Ⅰ.用高锰酸钾和浓盐酸反应制取氯气 a.该小组利用下图装置及试剂制备并收集适量Cl2 , 装置B、C的作用分别是、 . 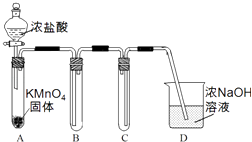
b.制得的氯气中加入适量水,得到饱和氯水,
饱和氯水中含氯元素的微粒有(写出全部微粒).
c.饱和氯水与石灰石的反应是制取较浓HC1O溶液的方法之一.在过量的石灰石中加入饱和氯水充分反应,有少量气泡产生,溶液浅黄绿色褪去,过滤,得到的滤液其漂白性比饱和氯水更强.
①滤液漂白性增强的原因是(用化学平衡移动原理解释).
②饱和氯水与石灰石反应生成HClO的方程式是 .
(2)ClO3﹣、Cl﹣和H+反应的探究 a.KClO3、KCl与硫酸可以反应.该小组设计了系列实验研究反应条件对反应的影响,实验记录如下(实验在室温下进行):
烧杯编号 | 1 | 2 | 3 | 4 |
氯酸钾饱和溶液 | 1mL | 1mL | 1mL | 1mL |
氯化钾固体 | 1g | 1g | 1g | 1g |
水 | 8mL | 6mL | 3mL | 0mL |
硫酸(6mol/L) | 0mL | 2mL | ()mL | 8mL |
现象 | 无现象 | 溶液呈浅黄色 | 溶液呈黄绿色,生成浅黄绿色气体 | 溶液呈黄绿色, |
①该系列实验的目的 .
②烧杯3取用硫酸的体积应为mL.
b.该小组同学查资料得知:将氯酸钾固体和浓盐酸混合也能生成氯气,同时有大量ClO2生成;ClO2沸点为10℃,熔点为﹣59℃,液体为红色;Cl2沸点为﹣34℃,液态为黄绿色.设计最简单的实验验证Cl2中含有ClO2 .


